Zadanie 13.
2013 maj
Wróć do listyW 1 dm3 pewnego wodnego roztworu znajdowało się
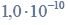
mola jonów Cl-
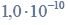
mola jonów I- oraz jony Na+. Do roztworu wprowadzono kroplę roztworu

zawierającą
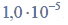
Iloczyny rozpuszczalności AgCl i AgI w temperaturze T, w której przeprowadzono doświadczenie, wynoszą:
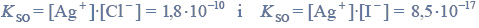
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Do wodnego roztworu zawierającego aniony chlorkowe (Cl-) i cząsteczki amoniaku (NH3) wprowadzono roztwór zawierający kationy srebra (Ag+). Nie zaobserwowano jednak wytrącenia osadu, który świadczyłby o powstaniu chlorku srebra (AgCl). Wynika to z faktu, że dla jonów Ag+ reakcją uprzywilejowaną w stosunku do reakcji tworzenia AgCl jest reakcja tworzenia jonu kompleksowego o liczbie koordynacyjnej 2, w którym rolę ligandów pełnią cząsteczki amoniaku.
Napisz w formie jonowej równanie reakcji prowadzącej do powstania opisanego jonu kompleksowego.
KOREPETYCJE