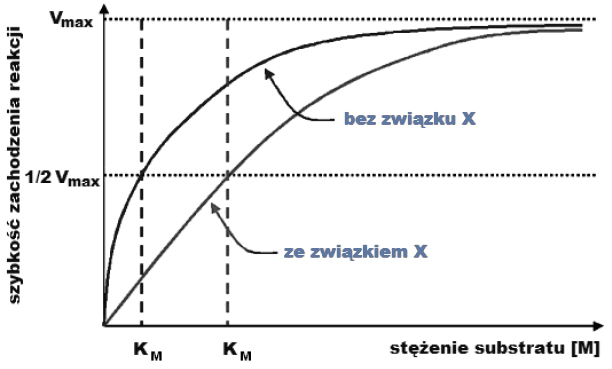
Zależność szybkości reakcji od stężenia substratu.
Arkusz maturalny z biologii rozszerzonej grudzień 2013
Wróć do listyStała Michaelisa-Menten (KM) to takie stężenie substratu (dla określonego stężenia enzymu), przy którym reakcja enzymatyczna osiąga połowę prędkości maksymalnej. Stałą tę uznaje się za orientacyjną miarę powinowactwa enzymu do substratu, ponieważ w przypadku większego powinowactwa następuje wysycenie enzymu substratem przy jego niższym stężeniu.
W doświadczeniu badano zależność szybkości reakcji enzymatycznej od stężenia substratu – dla enzymu bez obecności związku X oraz dla enzymu w obecności związku X. Wyniki doświadczenia przedstawiono na poniższym wykresie.
Na podstawie:
http://www.mikeblaber.org/oldwine/BCH4053/Lecture25/Lecture25.htm [dostęp 10.02.2013]
a) Wybierz prawidłową interpretację wyników doświadczenia i jej uzasadnienie.
A. Związek X jest inhibitorem tego enzymu, ponieważ w jego obecności powinowactwo enzymu do substratu zwiększyło się.
B. Związek X jest inhibitorem tego enzymu, ponieważ w jego obecności powinowactwo enzymu do substratu zmniejszyło się.
C. Związek X jest aktywatorem tego enzymu, ponieważ w jego obecności powinowactwo enzymu do substratu zwiększyło się.
D. Związek X jest aktywatorem tego enzymu, ponieważ w jego obecności powinowactwo enzymu do substratu zmniejszyło się.
b) Korzystając z informacji przedstawionych na wykresie, wyjaśnij, dlaczego wartość Vmax tej reakcji nie zmienia się w obecności związku X.
KOREPETYCJE