kwasy i zasady – klasyfikacja zgodna z teorią Brønsteda–Lowry`ego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wróć do listyJon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
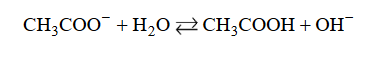
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:
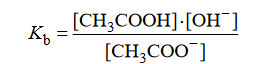
Iloczyn stałej dysocjacji kwasowej Ka kwasu CH₃COOH i stałej dysocjacji zasadowej Kb sprzężonej z nim zasady CH3COO⁻ jest równy iloczynowi jonowemu wody: Ka∙Kb = Kw. W temperaturze 25ºC iloczyn jonowy wody jest równy Kw = 1, 0 * 10⁻¹⁴.
Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 mol*dm⁻³ w temperaturze 25 ºC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych

KOREPETYCJE