Kolorymetria – metoda analizy chemicznej
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Wróć do listyKolorymetria jest metodą analizy chemicznej stosowaną do oznaczania małych stężeń substancji, których roztwory są barwne, na podstawie porównania intensywności barwy roztworu badanego i roztworu wzorcowego o znanym stężeniu. Intensywność zabarwienia roztworu zależy od absorpcji promieniowania elektromagnetycznego o określonej długości fali z zakresu światła widzialnego. Miarą absorpcji jest wielkość zwana absorbancją – oznaczana literą A. Absorbancja, jaką wykazuje dany roztwór, jest wprost proporcjonalna do stężenia barwnego składnika tego roztworu.
1. Metodę kolorymetryczną można zastosować do oznaczania miedzi(II) w postaci jonów
diakwatetraaminamiedzi(II), ponieważ roztwory, w których te jony występują, są barwne.
Z badanego wodnego roztworu zawierającego jony diakwatetraaminamiedzi(II) pobrano
próbki do pomiaru absorbancji (światło o długości fali
λ = 600 nm) i uzyskano średni wynik
A = 0,36. Następnie sporządzono krzywą wzorcową – wykonano pomiary absorbancji
A dla
czystej wody i dla dwóch próbek roztworów o znanym stężeniu miedzi(II) w postaci jonów
diakwatetraaminamiedzi(II). Za każdym razem warunki pomiaru były takie same jak te,
w jakich wykonano pomiary dla roztworu badanego. Otrzymane wyniki zestawiono w tabeli.

Narysuj wykres krzywej wzorcowej, a następnie odczytaj z niego stężenie miedzi(II) w badanym roztworze.
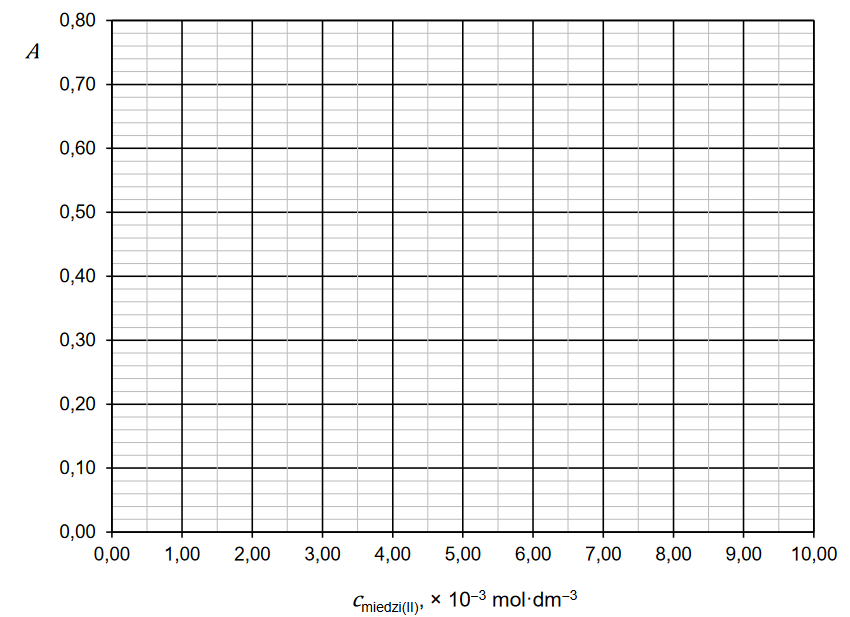
Stężenie miedzi(II) w badanym roztworze: mol ∙ dm–3.
2. Kolorymetryczne oznaczenie bardzo małych ilości miedzi(II) można wykonać, jeżeli zmierzy się absorbancję roztworu kompleksu miedzi(II) z dietyloditiokarbaminianem, w skrócie oznaczanego wzorem Cu(DDTK)2. Ten związek słabo rozpuszcza się w wodzie, ale dobrze – w rozpuszczalnikach organicznych. W drugiej z tych sytuacji powstaje roztwór o barwie żółtobrunatnej.
Aby wyznaczyć masę miedzi w próbce badanego wodnego roztworu zawierającego jony
miedzi(II), do tego roztworu dodano roztwór dietyloditiokarbaminianu sodu NaDDTK. Następnie otrzymaną mieszaninę wytrząsano z rozpuszczalnikiem organicznym, co spowodowało, że obecny w wodzie Cu(DDTK)2 przeszedł ilościowo do fazy organicznej. Wszystkie porcje roztworu Cu(DDTK)2 w rozpuszczalniku organicznym połączono i uzupełniono tym rozpuszczalnikiem do objętości 25 cm3. Metodą kolorymetryczną wyznaczono stężenie miedzi(II) w badanym roztworze, które było równe 3,50·10–5 mol·dm–3.
Oblicz, ile mikrogramów miedzi w postaci miedzi(II) zawierała próbka badanego wodnego roztworu (1 μg = 10–6 g). Przyjmij masę molową miedzi równą 63,55 g∙mol–1
3. Napisz nazwę metody, za pomocą której wyodrębniono kompleks miedzi(II) z roztworu wodnego.

KOREPETYCJE