Obliczanie pH roztworu octanu sodu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Wróć do listyJon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą
Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
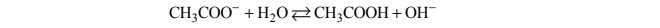
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:

Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 − ⋅ 3 mol dm w temperaturze
25 oC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych.

Wskazówki rozwiązania:
- kwas octowy jak wszystkie kwasy organiczne jest kwasem słabym, to znaczy, że w roztworze wodnym dysocjuje część cząsteczek.
- octan sodu jest solą, to dobrze rozpuszczalny związek, który jest świetnym źródłem jonów octanowych.
- zwróćmy uwagę, że stała dysocjacji nie zmienia się w zależności od stężenia, ale ma na nią wpływ temperatura.
- iloczyn jonowy wody to iloczyn stężenia jonów: kationów hydrioniowych oraz anionów hydroksylowych
- suma pH i pOH wynosi 14
KOREPETYCJE