Zadanie 21.
2014 maj
Wróć do listySiarczki są solami słabego kwasu siarkowodorowego, dlatego możliwość ich wytrącenia zależy nie tylko od iloczynu rozpuszczalności, lecz także od pH roztworu. W roztworach o niskim pH stężenie jonów siarczkowych jest bardzo małe, więc stężenie jonów metalu musi być odpowiednio duże, aby zostać przekroczony iloczyn rozpuszczalności. Dla roztworu o znanym pH można obliczyć najmniejsze stężenie molowe kationów danego metalu c, jakie musi istnieć w roztworze o tym pH, aby zacząć się wytrącać osad siarczku tego metalu.
Na poniższym wykresie przedstawiono zależność logarytmu z najmniejszego stężenia c kationów
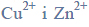
(log c), przy którym następuje strącanie siarczków miedzi(II) i cynku, od pH roztworu.
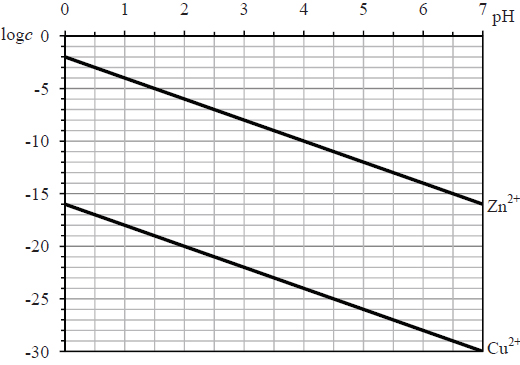
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Przygotowano dwa roztwory wodne, których pH było równe 1. Roztwór I zawierał jony Zn2+ o stężeniu c równym
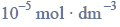
a roztwór II zawierał jony Cu2+ o stężeniu c równym
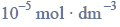
Czy w roztworze I wytrąci się osad ZnS, a w roztworze II osad CuS?
KOREPETYCJE