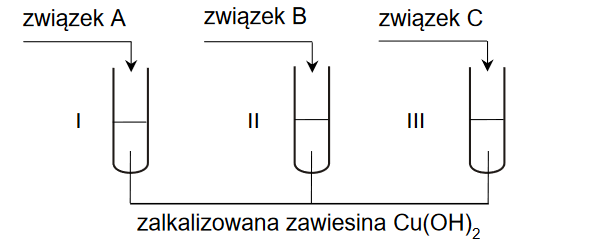
właściwości chemiczne fenoli w reakcji z wodorotlenkiem sodu
Arkusz diagnostyczny z chemii 2022 grudzień
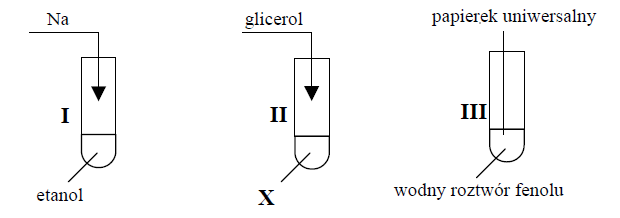
W temperaturze powyżej 67°C fenol miesza się z wodą w dowolnych proporcjach, natomiast w przedziale temperatury 15–40°C jego maksymalne stężenie w roztworze wodnym nie przekracza 10 %.
Do probówki wprowadzono fenol i wodę w stosunku masowym 1 : 5 i przeprowadzono doświadczenie.
Etap 1. Zawartość probówki ogrzano do temperatury 70 °C.
Etap 2. Mieszaninę ochłodzono do temperatury 25 °C.
Etap 3. Dodano stechiometryczną ilość wodorotlenku sodu (w stosunku do fenolu).
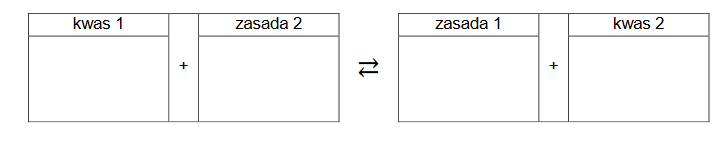
1. Uzupełnij tabelę. Opisz wygląd zawartości probówki po kolejnych etapach doświadczenia.

2. Po pewnym czasie stwierdzono, że mieszanina otrzymana w 3. etapie ma odczyn zasadowy.
Napisz równanie reakcji odpowiadającej za odczyn tej mieszaniny na podstawie definicji kwasów i zasad Brønsteda. Wzory odpowiednich drobin wpisz w poniższą tabelę.
właściwości chemiczne węglowodorów aromatycznych
Arkusz diagnostyczny z chemii 2022 grudzień
W wyniku działania kwasem azotowym(III) na pierwszorzędowe aminy aromatyczne powstają tzw. sole diazoniowe, które znajdują zastosowanie w syntezie organicznej.
W praktyce, zamiast nietrwałego kwasu azotowego(III) stosuje się jego sól w obecności mocnego kwasu. Przykład takiej reakcji z udziałem aniliny zilustrowano równaniem:
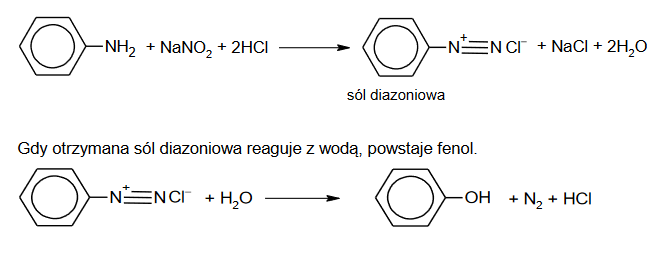
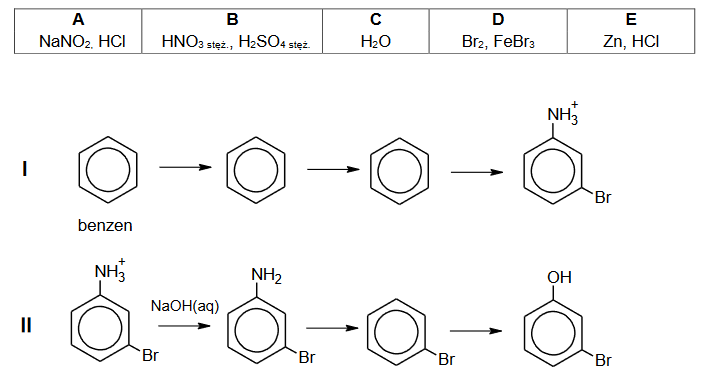
Opisane przemiany mogą być stosowane w celu otrzymania pochodnych benzenu, w których podstawniki kierujące w pozycje orto– i para– znajdują się względem siebie w pozycji meta–.
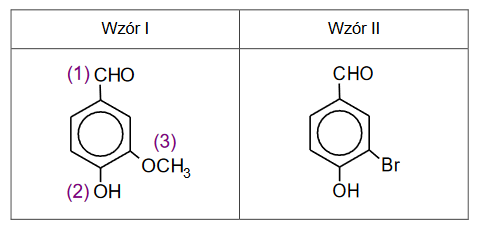
Zaprojektuj ciąg przemian, w wyniku których z benzenu powstanie 3–bromofenol – uzupełnij w poniższym, dwuczęściowym schemacie wzory produktów pośrednich, a nad każdą strzałką wpisz literę oznaczającą zestaw użytych reagentów. Zestawy odczynników wybierz spośród wymienionych poniżej.
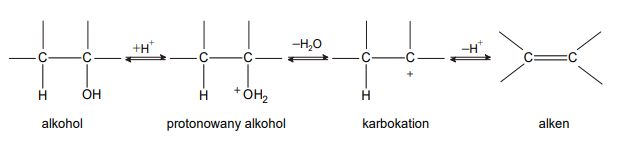
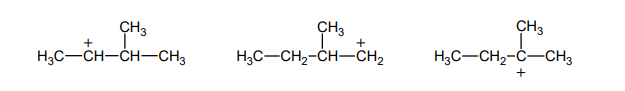
odróżnianie alkoholi trzeciorzędowych od alkoholi pierwszo- i drugorzędowych
Arkusz diagnostyczny z chemii 2022 grudzień
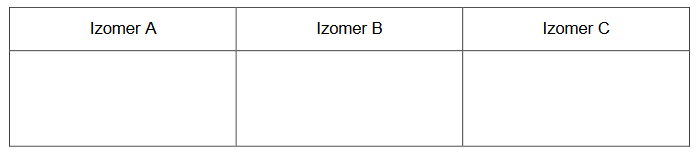
Izomeryczne związki A, B i C należące do jednej klasy związków organicznych mają wzór sumaryczny C₄H₁₀O. Jeden z tych związków ma rozgałęziony łańcuch węglowy. Izomer A został wprowadzony do roztworu K₂Cr₂O₇ z dodatkiem kwasu siarkowego(VI) i na zdjęciu obok pokazano, jak wygląda zawartość probówki na początku tego doświadczenia (1) oraz po pewnym czasie (2).

Wiadomo, że cząsteczki związku A nie są chiralne, ale jego izomer B, który podobnie zachowałby się w opisanym doświadczeniu, wykazuje czynność optyczną. Izomer C nie ulega działaniu jonów dichromianowych(VI).
Napisz wzory półstrukturalne (grupowe) izomerów A, B, C.
właściwości chemiczne kwasów karboksylowych
Arkusz diagnostyczny z chemii 2022 grudzień
Uczniowie badali zachowanie związków organicznych wobec kwasów i zasad. Mieli do dyspozycji: propano–1–aminę, propan–1–ol, glicynę oraz kwas propanowy. Te związki zostały w przypadkowej kolejności oznaczone numerami 1–4.
W pierwszym etapie doświadczenia badane związki wprowadzono pojedynczo do czterech probówek zawierających kwas solny z dodatkiem oranżu metylowego, a w drugim etapie – do czterech probówek zawierających roztwór NaOH z dodatkiem fenoloftaleiny. Efekty doświadczenia pokazano na zdjęciach.

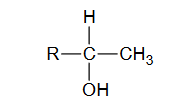
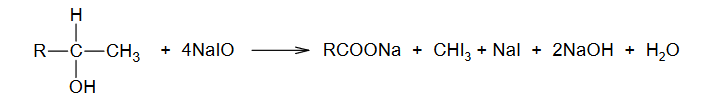
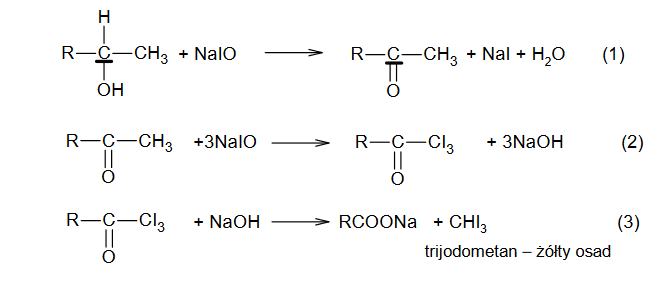
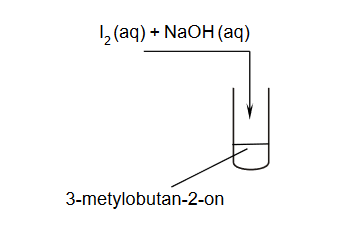
Identyfikacja alkoholi
INFORMATOR o egzaminie maturalnym z chemii 22/23
W dwóch probówkach A i B znajdują się oddzielnie dwa alkohole: 2-metylopropan-2-ol i butan-1-ol. Do obu probówek dodano wodny roztwór manganianu(VII) potasu i parę kropli wodnego roztworu kwasu siarkowego(VI). Następnie zawartość probówek dokładnie wymieszano. Po pewnym czasie od wykonania doświadczeń roztwory w próbówkach wyglądały tak jak na zdjęciach poniżej:

Podaj nazwę alkoholu, który znajdował się w probówce A. Odpowiedź uzasadnij.
Nazwa alkoholu:
Uzasadnienie: