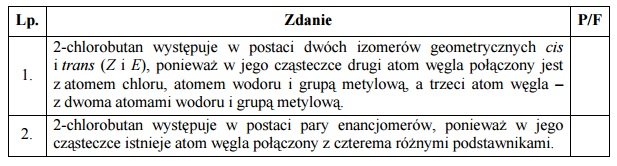
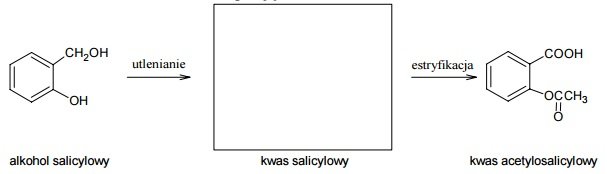
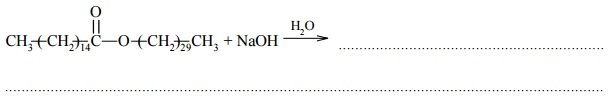
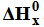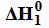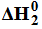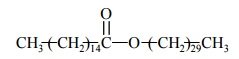Miareczkowanie. Wykres miareczkowania.
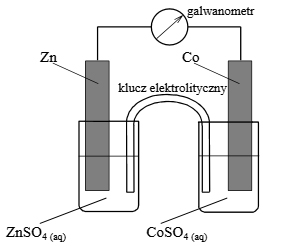
Arkusz maturalny z chemii rozszerzonej maj 2008
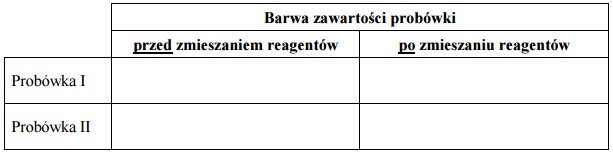
Do 100 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami kwas solny o stężeniu 0,20 mol/dm3 i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. Otrzymane wyniki umieszczono na wykresie ilustrującym zależność pH od objętości dodanego HCl.
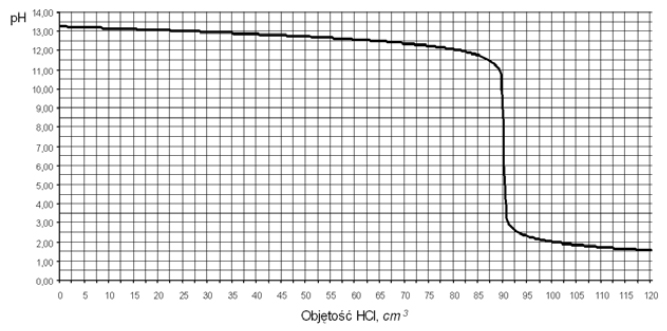
a) Z powyższego wykresu odczytaj objętość kwasu solnego potrzebną do zobojętnienia wodorotlenku sodu znajdującego się w badanym roztworze. b) Oblicz stężenie molowe badanego roztworu wodorotlenku sodu. Wynik podaj z dokładnością do dwóch miejsc po przecinku.