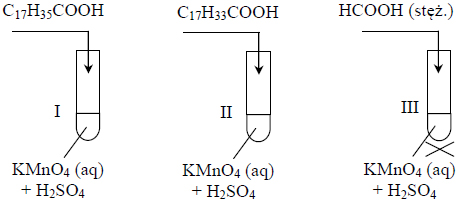
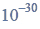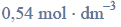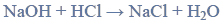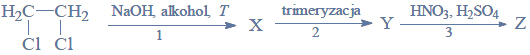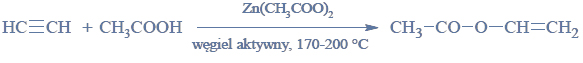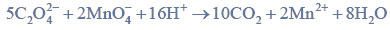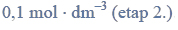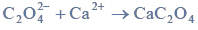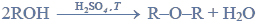Redukcja estru z udziałem tetrahydroglinianu litu.
Arkusz maturalny z chemii rozszerzonej grudzień 2014
Aldehydy i ketony ulegają redukcji wodorem do odpowiednich alkoholi, przy udziale katalizatora, np. platyny.
Estry ulegają redukcji, dając alkohole pierwszorzędowe. Reduktorem stosowanym zazwyczaj do redukcji estrów jest tetrahydroglinian litu (LiAlH4). Redukcja estrów przebiega według schematu:
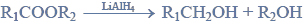
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2003.
a) Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji redukcji propanalu wodorem. Zaznacz warunki prowadzenia procesu.
b) Napisz wzory półstrukturalne (grupowe) związków otrzymanych w wyniku redukcji propanianu etylu.