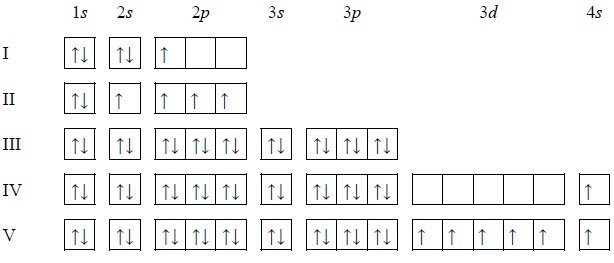
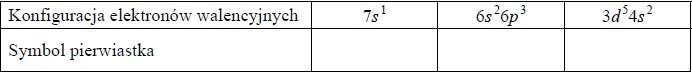
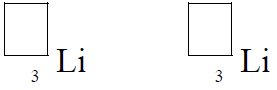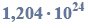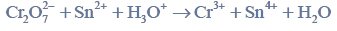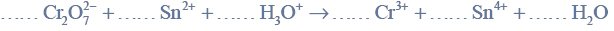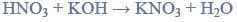w tabeli przedstawiono rozpuszczalność chlorku potasu kcl w zależności od temperatury
Arkusz maturalny z chemii rozszerzonej czerwiec 2015 nowa formuła
W poniższej tabeli przedstawiono rozpuszczalność chlorku potasu w wodzie w temperaturze 20 ºC i 40 ºC.
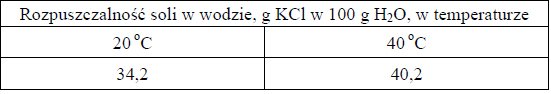
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Oblicz, ile gramów KCl należy dodać do 250 gramów nasyconego w temperaturze 20 ºC roztworu tej soli, aby po ogrzaniu mieszaniny do 40 ºC dodana sól rozpuściła się całkowicie, a roztwór pozostał nasycony. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Wskazówki:
- Zarówno chlorek potasu – KCl jak i chlorek sodu – NaCl to sole bardzo dobrze rozpuszczalne w wodzie. Tworzą bezbarwne roztwory, a jedną z metod ich odróżnienia jest barwa płomienia spalanej soli.
- Rozpuszczalność soli rośnie wraz ze wzrostem temperatury, natomiast wręcz przeciwnie jest z gazami, ich rozpuszczalność spada ze wzrostem temperatury.
- W roztworze nasyconym nie może roztworzyć się więcej substancji, jest tam woda i substancja rozpuszczona.