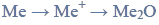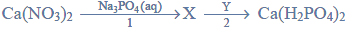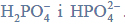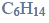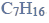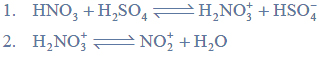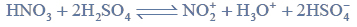Związki cykliczne.
Arkusz maturalny z chemii rozszerzonej czerwiec 2015 nowa formuła
Pewne cykliczne jednopierścieniowe nasycone związki organiczne są izomerami symetrycznego ketonu i mają masę molową mniejszą niż

Napisz wzory półstrukturalne (grupowe) dwóch związków organicznych spełniających opisane warunki.
Reakcja związku organicznego z sodem.
Arkusz maturalny z chemii rozszerzonej czerwiec 2015 nowa formuła
Pewien związek organiczny X o wzorze sumarycznym

reaguje z sodem, a jednym z produktów tej reakcji jest wodór. W wyniku utleniania związku X tlenkiem miedzi(II) powstaje optycznie czynny aldehyd, a tlenek miedzi(II) redukuje się do miedzi metalicznej.
Napisz równania reakcji związku X z sodem i tlenkiem miedzi(II). Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
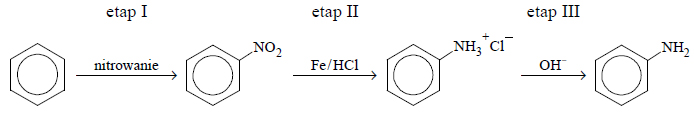
Chlorowanie alkanów w obecności światła.
Arkusz maturalny z chemii rozszerzonej czerwiec 2015 nowa formuła
W wyniku monochlorowania propanu w obecności światła otrzymano dwa izomeryczne produkty A i B, które rozdzielono metodami fizycznymi. Na produkt A podziałano metalicznym sodem, otrzymując związek C, który jest jednym z izomerów o wzorze
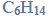
Z produktu B otrzymano alkohol, z którego w reakcji z CuO otrzymano propanal.
1. Uzupełnij schemat ilustrujący proces otrzymywania propanalu z propanu – wpisz wzory półstrukturalne (grupowe) związków organicznych oraz odczynnik wybrany spośród wymienionych poniżej.
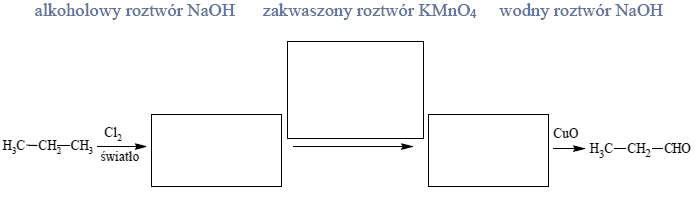
2. Narysuj wzór półstrukturalny (grupowy) związku C i podaj jego nazwę systematyczną.