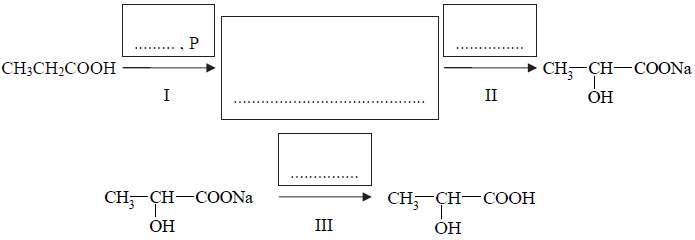
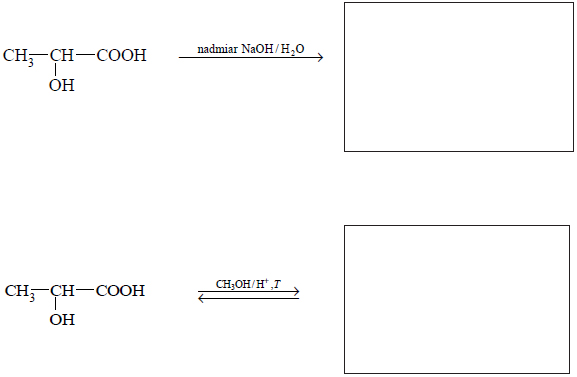
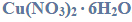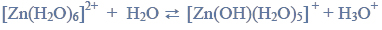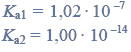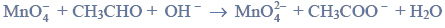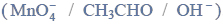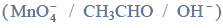Reakcje charakterystyczne aldehydów i ketonów.
Arkusz maturalny z chemii rozszerzonej czerwiec 2015 stara formuła
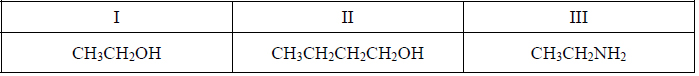
W poniższej tabeli podano wzory czterech związków organicznych.

Uzupełnij poniższe zdania, tak aby powstały informacje prawdziwe.
1. Związek I ulega reakcji polimeryzacji, co można opisać równaniem: ……….
2. Związek IV jest izomerem związku oznaczonego numerem ……….. i homologiem związku oznaczonego numerem ……….. .
3. Związek III powstał w wyniku utleniania alkoholu o wzorze półstrukturalnym (grupowym) ……….
4. W wyniku redukcji wodorem związku II powstaje alkohol o wzorze półstrukturalnym (grupowym) ……….