Budowa i reakcje kwasu cytrynowego.
Informator maturalny z chemii CKE 2015
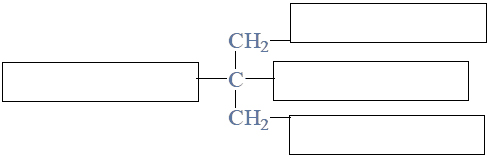
Poniżej przedstawiono wzór półstrukturalny (grupowy) kwasu cytrynowego.
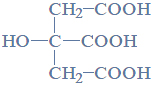
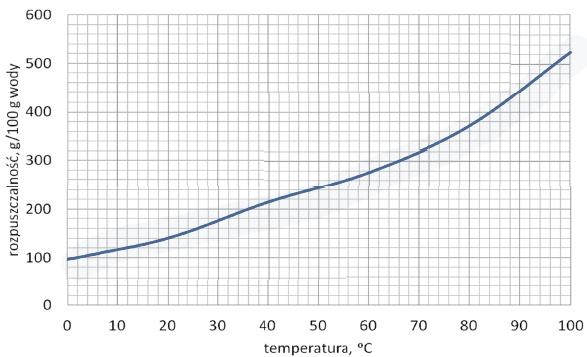
Wykres zamieszczony poniżej przedstawia zależność rozpuszczalności kwasu cytrynowego od temperatury.
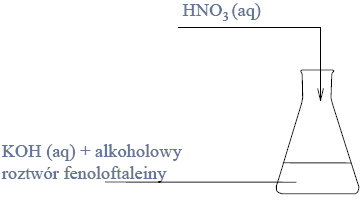
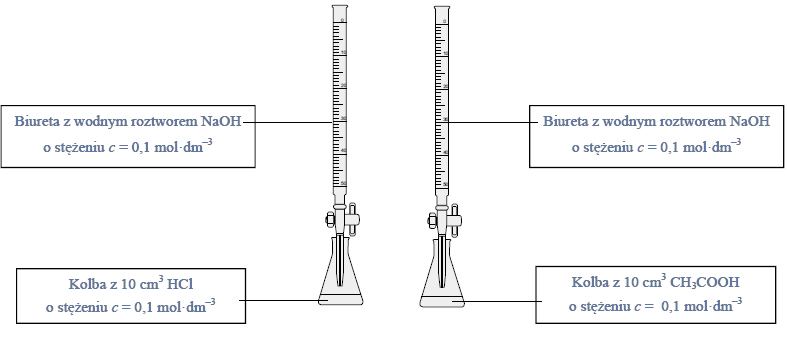
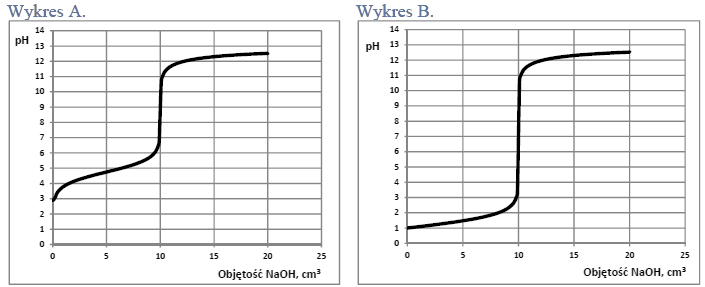
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
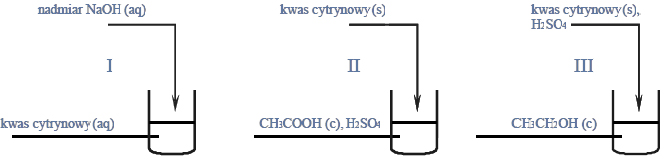
Naczynie II dodatkowo ogrzano. W naczyniu III otrzymano kilka produktów, wśród nich związki, których cząsteczki są chiralne.
Oceń, czy można przygotować wodny roztwór kwasu cytrynowego o stężeniu 75% masowych o temperaturze 20 °C. Wykonaj odpowiednie obliczenia oraz uzasadnij swoją ocenę.
Czy kwas cytrynowy jest chiralny?
Informator maturalny z chemii CKE 2015
Poniżej przedstawiono wzór półstrukturalny (grupowy) kwasu cytrynowego.
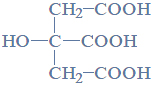
Wykres zamieszczony poniżej przedstawia zależność rozpuszczalności kwasu cytrynowego od temperatury.

Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.

Naczynie II dodatkowo ogrzano. W naczyniu III otrzymano kilka produktów, wśród nich związki, których cząsteczki są chiralne.
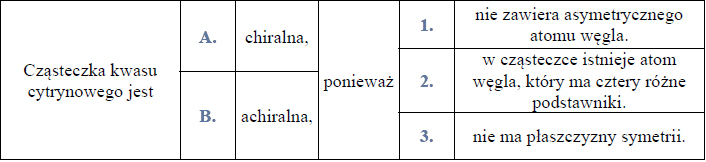
Czy cząsteczka kwasu cytrynowego jest chiralna, czy achiralna? Wybierz i podkreśl odpowiedź A. albo B. oraz jej uzasadnienie 1. albo 2. albo 3.
Uzupełnij poniższy schemat, tak aby otrzymać wzór półstrukturalny chiralnego produktu organicznego reakcji przebiegającej w naczyniu III.