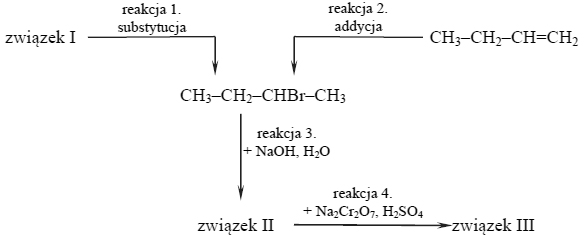
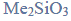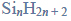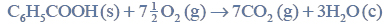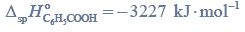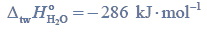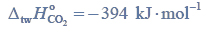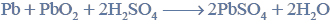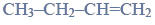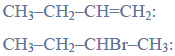Lotność aldehydów i alkoholi.
Arkusz maturalny z chemii rozszerzonej maj 2015 stara formuła
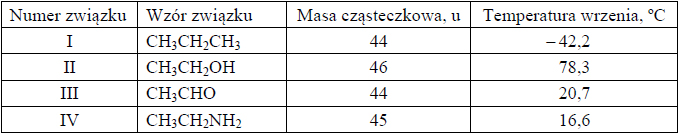
W poniższej tabeli zestawiono wartości temperatury wrzenia (pod ciśnieniem 1013 hPa) alkanu, alkanolu, alkanalu i alkiloaminy o zbliżonych masach cząsteczkowych.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Spośród związków o wzorach podanych w tabeli wybierz substancję najmniej i najbardziej lotną. Napisz wzory wybranych związków.
Przyczyna różnic temperatur wrzeniaalkoholi i aldehydów.
Arkusz maturalny z chemii rozszerzonej maj 2015 stara formuła
W poniższej tabeli zestawiono wartości temperatury wrzenia (pod ciśnieniem 1013 hPa) alkanu, alkanolu, alkanalu i alkiloaminy o zbliżonych masach cząsteczkowych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Opisz przyczynę różnicy temperatury wrzenia alkanu i aldehydu oraz przyczynę różnicy temperatury wrzenia aldehydu i alkoholu. Odnieś się do budowy cząsteczek związków, których wzory wymieniono w tabeli.