Struktura atomu – jądro i elektrony
Arkusz z chemii rozszerzonej marzec 2021
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar]3d¹⁰.
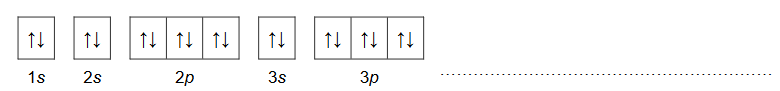
1. Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek.

2 .Uzupełnij poniższy schemat. Przedstaw pełną konfigurację elektronową atomu (w stanie podstawowym) pierwiastka X. Zastosuj schemat klatkowy. W zapisie uwzględnij numery powłok i symbole podpowłok.
Pierwsza energia jonizacji – minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu
Arkusz z chemii rozszerzonej marzec 2021
Pierwsza energia jonizacji (Ej 1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej 2, Ej 3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
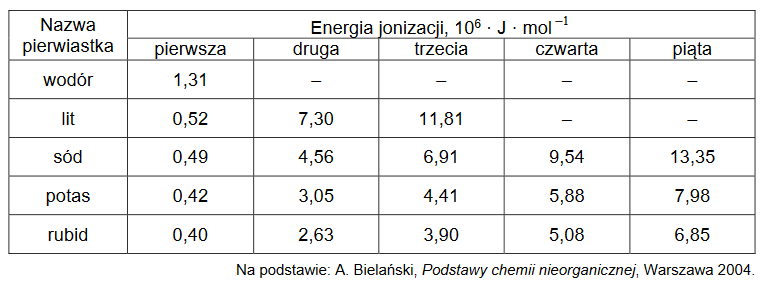
1. Wyjaśnij, dlaczego wartość pierwszej energii jonizacji atomu wodoru jest dużo większa niż wartość pierwszej energii jonizacji atomów kolejnych pierwiastków pierwszej grupy.
2. Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Pierwsza energia jonizacji litowca jest (mniejsza / większa) niż druga energia jonizacji, ponieważ:
• (łatwiej / trudniej) oderwać elektron od jonu naładowanego dodatnio niż od obojętnego atomu
oraz
• przyciąganie przez jądro elektronu z przedostatniej powłoki jest (silniejsze / słabsze) niż przyciąganie elektronu z powłoki ostatniej.
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Sacharoza – cukier dobrze rozpuszczalny w wodzie
Arkusz z chemii rozszerzonej marzec 2021
Sacharoza dobrze rozpuszcza się w wodzie, a jej rozpuszczalność w dużym stopniu zależy od temperatury.
Przygotowano nasycony wodny roztwór sacharozy w temperaturze 80 °C. Następnie ochłodzono go do temperatury 20 °C i stwierdzono, że wykrystalizowało 1590 g sacharozy, a roztwór, który pozostał po krystalizacji, miał masę 3040 g.
Oblicz rozpuszczalność sacharozy (w gramach na 100 gramów wody) w temperaturze 80 °C, jeśli w temperaturze 20 °C jest ona równa 204 g na 100 g wody.
Katalizator i jego wpływ na energię aktywacji i wydajność procesu
Arkusz z chemii rozszerzonej marzec 2021
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Działanie katalizatora prowadzi do (obniżenia / podwyższenia) energii aktywacji katalizowanej reakcji. Obecność katalizatora (wpływa / nie wpływa) na wydajność procesu. Katalizatory (zmieniają szybkość / nie zmieniają szybkości), z jaką układ osiąga stan równowagi.
stan równowagi dynamicznej i stała równowagi
Arkusz z chemii rozszerzonej marzec 2021
Poniżej przedstawiono równanie reakcji syntezy amoniaku.
N₂ + 3H₂ ⇄ 2NH₃ Δ𝐻 = – 91,8 kJ
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Wzrost temperatury w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku. Dodanie do reaktora większej ilości wodoru przyczyni się do (spadku / wzrostu) ilości amoniaku w mieszaninie poreakcyjnej. Obniżenie ciśnienia w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku.
Materiały i tworzywa pochodzenia naturalnego
Arkusz z chemii rozszerzonej marzec 2021
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm³ roztworu, po czym dodano do niego 50,0 cm³ roztworu azotanu(V) baru o stężeniu 0,600 mol·dm⁻³. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe:
M Na₂SO₄ =142 g mol⁻¹
M BaSO₄ = 233 g mol⁻¹
analiza i porównanie właściwości chemicznych metali
Arkusz z chemii rozszerzonej marzec 2021
Do dwóch zlewek zawierających jednakowe objętości wody o temperaturze t = 20 °C dodano:
• do zlewki I – próbkę metalicznego magnezu
• do zlewki II – próbkę metalicznego wapnia.
Tylko w jednej zlewce zaobserwowano objawy reakcji chemicznej.
Napisz w formie jonowej równanie reakcji zachodzącej podczas opisanego doświadczenia. Wyjaśnij przyczynę różnej aktywności chemicznej badanych metali.
Równanie reakcji:
Wyjaśnienie:
interpretacja wartości stałej dysocjacji, pH, pKw
Arkusz z chemii rozszerzonej marzec 2021
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm⁻³.
1. Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
2. Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
3. Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Przygotowywanie i rozcieńczanie roztworów
Arkusz z chemii rozszerzonej marzec 2021
Odmierzono 10,0 cm³ kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm⁻³ , a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm³ .
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
charakter chemiczny wodorotlenku glinu
Arkusz z chemii rozszerzonej marzec 2021
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
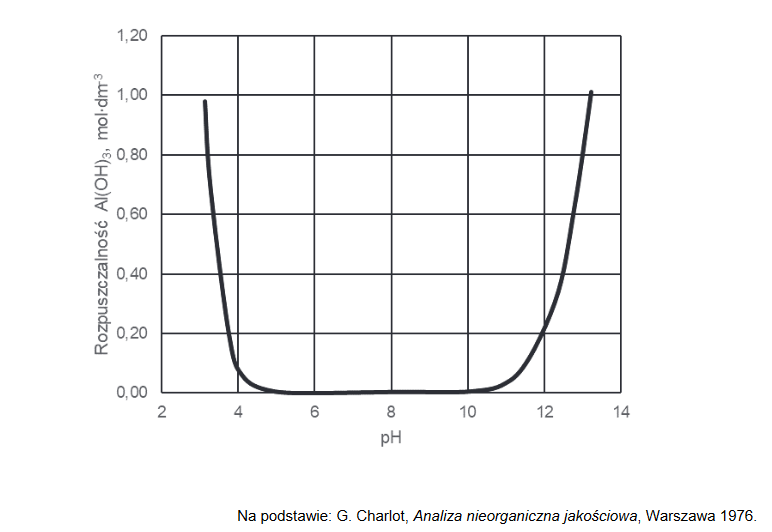
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu.
Charakter chemiczny:
Równania reakcji:
otrzymywanie wodorotlenków i soli różnymi metodami
Arkusz z chemii rozszerzonej marzec 2021
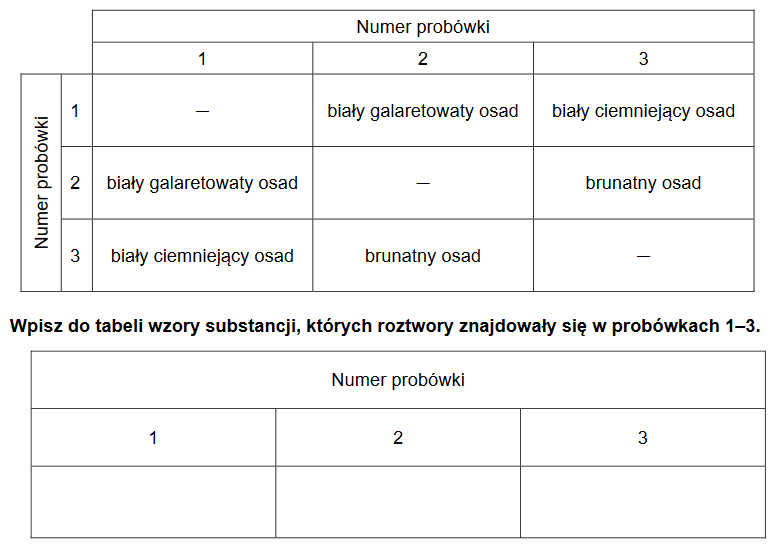
W trzech ponumerowanych probówkach znajdowały się bezbarwne wodne roztwory: azotanu(V) srebra(I), chlorku glinu i wodorotlenku potasu. Roztwory mieszano ze sobą, a obserwacje z przeprowadzonych doświadczeń przedstawiono w poniższej tabeli.
dobieranie współczynników w równaniach reakcji chemicznych
Arkusz z chemii rozszerzonej marzec 2021
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.).
Równanie 1.:
Równanie 2.: