7 lutego, 2021
Charakterystyka pierwiastków z bloku s
Litowce, berylowce i wodór.
Blok s układu okresowego obejmuje pierwsze dwie spośród 18 jego grup. Jedną z nich określa się zwyczajowo mianem litowców (od położonego pod wodorem litu) lub metali alkalicznych. Druga natomiast znana jest pod nazwą berylowce; rzadziej też jako metale ziem alkalicznych – choć sformułowanie to jest współcześnie niemal nieużywane w literaturze. Ten zgrubnie nakreślony podział na grupy przyda nam się przy omawianiu właściwości pierwiastków do nich należących z uwagi na to, że w ich obrębie występuje wiele cech wspólnych. Nazwa bloku ściśle nawiązuje do powłoki, będącej powłoką walencyjną dla wszystkich należących do niej pierwiastków
I tak: litowce (wraz z wodorem, który omówiony zostanie oddzielnie) stanowią, jak już zostało wspomniane, pierwszą grupę układu okresowego. Wymieniając od góry są to kolejno: lit, sód, potas, rubid, cez i frans.
Ostatni z nich często jest pomijany w podobnych charakterystykach z uwagi na to, że nie istnieją jego stabilne izotopy. Frans został odkryty jako radioaktywny produkt rozpadu uranu-235 i do dziś nikomu nie udało się uzyskać go w ilości większej niż kilka atomów. Także jego związki okazywały się dotychczas niemożliwe do zsyntezowania.
Lit, sód i potas mają gęstość mniejszą od wody, a co za tym idzie umieszczone w niej, unoszą się na powierzchni. Wszystkie pierwiastki tej grupy to ciała stałe o srebrzystobiałym, metalicznym połysku i niewielkiej twardości, która maleje wraz ze wzrostem liczby atomowej. Podobnie dzieje się z temperaturami przejść fazowych – wrzenia i topnienia – oraz z energią jonizacji. Niższa energia jonizacji równoznaczna jest z faktem, że oderwanie elektronu walencyjnego od powłoki jest łatwiejsze w związku z większym promieniem atomowym i mniejszą siłą przyciągania dodatniego ładunku jądra; mówiąc prościej wraz ze wzrostem numeru okresu, litowce chętniej tworzą kationy i wymaga to dostarczenia mniejszej ilości energii. Odwrotnie dzieje się ze wspomnianym już promieniem atomowym i jonowym oraz z gęstością – im wyższy numer okresu, tym pierwiastek jest „większy” i „cięższy”.
Spośród właściwości fizycznych tych pierwiastków na uwagę zasługuje ich zdolność do barwienia płomienia. Z uwagi na to, że litowce nie wykazują żadnych specyficznych reakcji chemicznych umożliwiających ich rozróżnienie, jest to cecha często wykorzystywana do ich identyfikacji w tzw. próbie płomieniowej. Pod wpływem temperatury atomy pierwiastków ulegają wzbudzeniu, a wracając do swojego stanu podstawowego, oddają energię w postaci fali o częstotliwości z zakresu promieniowania widzialnego. Objawem tego zjawiska jest widocznie zmieniona barwa płomienia palnika. Poniższa tabela przedstawia zależność koloru płomienia od kationu obecnego w spalanej próbce:
| nazwa litowca | kolor płomienia |
| lit | karminowy |
| sód | żółty |
| potas | fiołkowy |
| rubid | fioletoworóżowy |
| cez | fioletoworóżowy |
Litowce to pierwiastki o właściwościach higroskopijnych i silnie alkalicznych. Na powłoce walencyjnej mają po jednym elektronie, który chętnie oddają i ulegając jonizacji, tworzą kationy typu Me+. Łatwo wchodzą w reakcje z wodą, w wyniku czego powstają wodorotlenki z jednoczesnym wydzieleniem wodoru, zgodnie z równaniem:
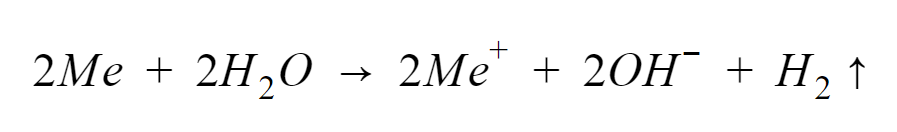
Niektóre z tych reakcji przebiegają bardzo gwałtownie – np. potas, rubid i cez niemal zawsze reagują z wodą wybuchowo, podczas gdy w przypadku sodu ma to miejsce tylko czasami, szczególnie wtedy, gdy użyty zostaje większy kawałek tego metalu. Wyjątek natomiast stanowi lit, który reaguje z wodą dosyć łagodnie.
Wodorotlenek cezu jest najsilniejszą znaną zasadą, jednak wodorotlenki pozostałych litowców również wykazują właściwości silnie zasadowe. Z uwagi na różnice elektroujemności pierwiastków, wchodzących w ich skład, mają budowę jonową. W środowisku wodnym występują w postaci kationów metali i anionów wodorotlenkowych. Takie roztwory są elektrolitami – bardzo dobrze przewodzą prąd elektryczny. Rozpuszczaniu wodorotlenków towarzyszy wydzielanie dużych ilości ciepła – jest to więc reakcja silnie egzotermiczna. Związki te mają zdolność do przewodzenia prądu elektrycznego także po stopieniu.
Pierwiastki pierwszej grupy układu okresowego to także najbardziej reaktywne spośród wszystkich znanych obecnie. Reaktywność ta wzrasta wraz z numerem okresu; czyli od litu do fransu. W związku z tą cechą przechowywane są najczęściej w nafcie, która izoluje je od powietrza, uniemożliwiając zachodzenie reakcji metalu ze składnikami tej mieszaniny.
Litowce w reakcjach z wodorem dają wodorki, a z fluorowcami (np. chlor, fluor), tworzą odpowiednie sole – tzw. halogenki. Dla sodu reakcje te zachodzą wg następujących schematów:
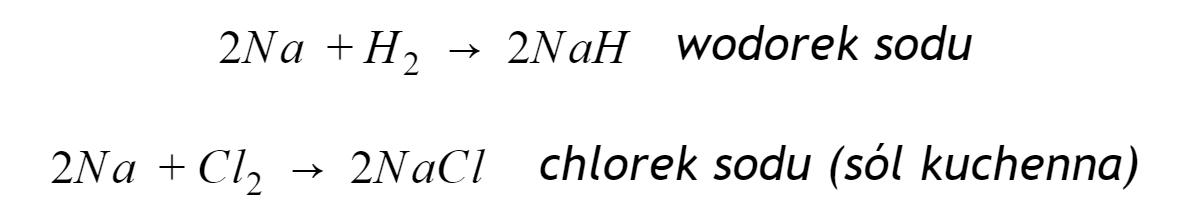
Warto także pamiętać, że litowce reagują z tlenem tworząc tlenki (lit), nadtlenki (sód) i podtlenki (potas i pozostałe), a wszystkie ich sole są dobrze rozpuszczalne w wodzie.
Na skalę przemysłową metale te uzyskuje się najczęściej w procesie elektrolizy stopionych soli (podobnie jak berylowce) lub ich roztworów wodnych. W drugim przypadku wykorzystuje się w tym celu elektrodę rtęciową, z którą wydzielany metal tworzy amalgamat.
Wodór to najszerzej rozpowszechniony pierwiastek we wszechświecie, który pomimo swojego położenia w pierwszej grupie układu okresowego, posiada właściwości inne niż pozostali jej przedstawiciele. Podobnie jak oni ma jednak jeden elektron na powłoce walencyjnej, który może oddawać tworząc kation hydroniowy H+, równoznaczny protonowi. Ponadto w związkach z metalami, w wyniku większej elektroujemności, jest zdolny do tworzenia anionu wodorkowego H– poprzez przyjęcie dodatkowego elektronu. Tym samym uzyskuje dublet elektronowy na powłoce walencyjnej.
Wymienianie wspomnianych wyżej różnic należałoby zacząć od tego, że jest niemetalem. Ponadto występuje w środowisku jako dwuatomowa cząsteczka bezwonnego, bezbarwnego i łatwopalnego gazu. Jest najprostszym spośród pierwiastków – posiada jeden proton w jądrze i jeden elektron, krążący na podpowłoce 1s. W zależności od ilości neutronów w jądrze, może występować pod postacią trzech izotopów:
- prot – nie posiada neutronów; jego jądro stanowi jeden proton, wokół którego krąży elektron
- deuter – posiada jeden neutron w jądrze atomowym
- tryt – posiada dwa neutrony w jądrze atomowym i jest izotopem radioaktywnym
Prot stanowi ponad 99,98% wszystkich atomów wodoru występujących w przyrodzie. Deuter z kolei stanowi około 0,015%, natomiast tryt w środowisku naturalnym odnajdywany jest jedynie w ilościach śladowych. Tylko dwa pierwsze są izotopami stabilnymi.
Z tlenem lub powietrzem wodór tworzy tzw. mieszaninę piorunującą. Nazwa ta pochodzi od gwałtownej reakcji spalania wodoru, której towarzyszy charakterystyczny trzask. Jest to reakcja często wykorzystywana do identyfikacji tego pierwiastka.
Większość wodoru na Ziemi jest związana w postaci wody lub innych związków z uwagi na stosunkowo wysoką reaktywność jaką wykazuje ten pierwiastek względem innych niemetali. Oprócz H2O występuje m.in. w postaci wodorków, nadtlenku wodoru, wodorotlenków, kwasów (wg teorii kwasów Brønsteda-Lowry’ego) i w niemal wszystkich związkach organicznych, w których często może ulegać reakcjom substytucji (podstawienie) w wyniku czego jest zastępowany np. halogenkami.
Berylowce to pierwiastki drugiej grupy układu okresowego. Ich nazwa pochodzi od pierwszego z nich – berylu i obejmuje kolejno także: magnez, wapń, stront, bar i rad. Na ich powłoce walencyjnej występują dwa elektrony, które są chętnie przez nie oddawane, w wyniku czego dochodzi ostatecznie do powstania kationów Me2+.
Żaden z berylowców nie występuje w przyrodzie w stanie wolnym. Najczęściej związane są w postaci minerałów – np. wapń jest najpowszechniej występującym przedstawicielem tej grupy i wchodzi w skład m.in. wapienia i marmuru. Ostatni z nich – rad – jest pierwiastkiem promieniotwórczym i w środowisku naturalnym można go znaleźć jedynie w ilościach śladowych jako składnik rud uranu.
Właściwości fizyczne berylowców są zbliżone do właściwości litowców. Występują pod postacią miękkich i łatwo topliwych ciał stałych o metalicznym połysku i stosunkowo niskiej gęstości (choć wartości tego parametru są większe niż dla odpowiadających im litowców). Niektóre z nich w próbie płomieniowej również wykazują wyraźną zdolność barwienia płomienia. Poszczególne pierwiastki i kolory im odpowiadające przedstawia tabela poniżej:
| nazwa berylowca | kolor płomienia |
| wapń | ceglastoczerwony |
| stront | karminowoczerwony |
| bar | żółtozielony/jasnozielony |
| rad | karminowoczerwony |
Oprócz samego berylu, berylowce wykazują właściwości silnie zasadowe, rosnące w grupie wraz ze wzrostem numeru okresu. Rzecz ma się podobnie z tlenkami i wodorotlenkami tych metali. Związki berylu mają natomiast właściwości amfoteryczne – posiadają zdolność reagowania zarówno z kwasami jak i z zasadami; innymi słowy w zależności od właściwości drugiego reagenta, mogą zachowywać się jak kwas lub zasada.
Pierwiastki drugiej grupy, choć w nieco mniejszym stopniu niż litowce, są stosunkowo reaktywne,. W temperaturze pokojowej wapń, stront, bar i rad wchodzą w reakcje z tlenem oraz z wodą zgodnie z poniższym równaniem:
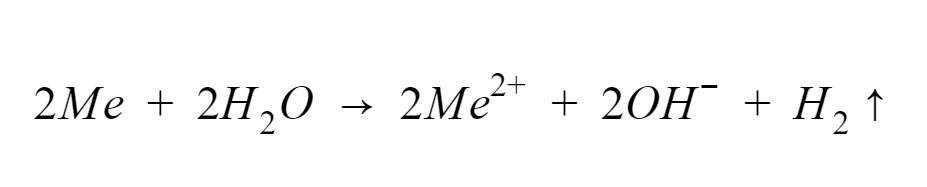
Tak jak przy udziale metali z grupy pierwszej, reakcja ta zachodzi z wydzieleniem wodoru. Warto jednak zaznaczyć, że niie dzieje się to zbyt gwałtownie. W przypadku magnezu mieszanina reakcyjna wymaga nawet podgrzania, by przedstawiona proces mógł zajść.
Berylowce w reakcjach z wodorem tworzą wodorki. Ponadto łatwo reagują z kwasami. W wyniku takich reakcji powstają sole, spośród których tylko część jest dobrze rozpuszczalna w wodzie. W tym miejscu warto wspomnieć, że kationy wapnia i magnezu mają związek ze zjawiskiem twardości wody i w postaci np. węglanów i siarczanów są częścią tzw. kamienia kotłowego powstającego w czajnikach podczas ogrzewania wody wodociągowej.
8 0 komentarze