Metoda VSEPR – określanie kształtu cząsteczek
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Wróć do listyMetoda VSEPR pozwala określać kształt cząsteczek zbudowanych z atomów pierwiastków grup głównych. W cząsteczce należy wyróżnić atom centralny (np. atom tlenu w cząsteczce H2O) i ustalić liczbę wolnych par elektronowych na jego zewnętrznej powłoce. Następnie zsumować liczbę podstawników związanych z atomem centralnym (𝑥) i liczbę jego wolnych
par elektronowych (𝑦). W ten sposób otrzymuje się tzw. liczbę przestrzenną (𝐿p = 𝑥 + 𝑦), która determinuje kształt cząsteczki. Ponieważ zarówno wolne, jak i wiążące pary elektronowe wzajemnie się odpychają, wszystkie elementy składające się na liczbę przestrzenną (podstawniki i wolne pary elektronowe) zajmują jak najbardziej odległe od siebie położenia wokół atomu centralnego.
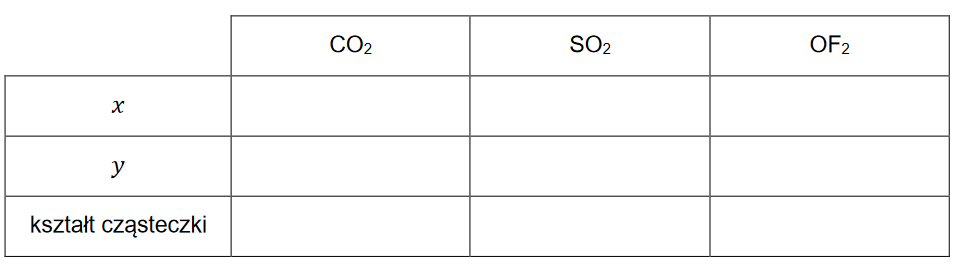
1. Uzupełnij poniższą tabelę – dla wymienionych cząsteczek napisz wartości 𝒙 i 𝒚 oraz określ kształt cząsteczki (liniowa, kątowa, trójkątna, tetraedryczna).
2. Poniżej przedstawiono dwa modele przestrzenne (I i II) różnych cząsteczek o wzorze ogólnym AB4.
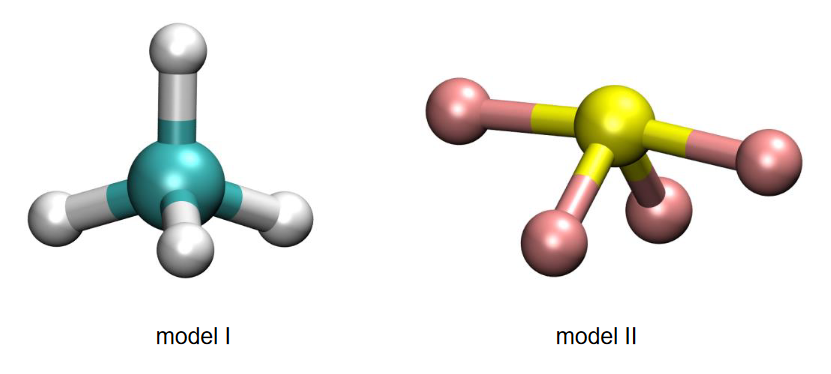
Rozstrzygnij, który z przedstawionych modeli (I albo II) jest ilustracją kształtu cząsteczki SF4. Uzasadnij swój wybór. Zastosuj metodę VSEPR.
Cząsteczkę SF4 przedstawia model:
Uzasadnienie:
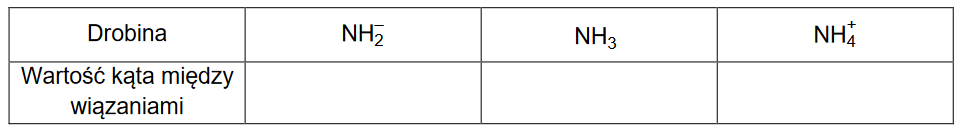
3. W teorii VSEPR przyjmuje się, że kąty między wiązaniami w drobinach zależą od siły, z jaką odpychają się pary elektronowe znajdujące się na zewnętrznej powłoce. Siła odpychania par elektronowych powłoki walencyjnej maleje w kolejności: wolna para elektronowa – wolna para elektronowa > wolna para elektronowa – wiążąca para elektronowa > wiążąca para elektronowa – wiążąca para elektronowa. Oznacza to, że w drobinach, w których nie ma wolnych par elektronowych, kąty między wiązaniami są najbardziej zbliżone do wartości teoretycznych opisujących idealną strukturę geometryczną drobiny, a w cząsteczkach zawierających wolne pary elektronowe obserwuje się zmniejszenie kątów między wiązaniami.
Wpisz do tabeli wartości kątów między wiązaniami N–H w wymienionych drobinach (NH2–, NH3, NH4+). Wartości tych kątów wybierz spośród następujących: 180°, 120°, 109°, 107°, 105°.

KOREPETYCJE