Zadanie 3.
2015 czerwiec sr
Wróć do listyMiarą tendencji atomów do oddawania elektronów i przechodzenia w dodatnio naładowane jony jest energia jonizacji. Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania jednego elektronu od atomu. Na poniższym wykresie przedstawiono zmiany pierwszej energii jonizacji pierwiastków uszeregowanych według rosnącej liczby atomowej.
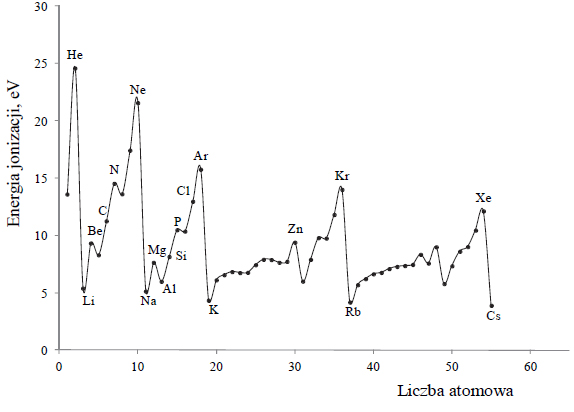
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Korzystając z informacji, uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie. 1. Spośród pierwiastków danego okresu litowce mają (najniższe / najwyższe), a helowce – (najniższe / najwyższe) wartości pierwszej energii jonizacji. Litowce są bardzo dobrymi (reduktorami / utleniaczami). Potas ma (niższą / wyższą) wartość pierwszej energii jonizacji niż sód, ponieważ w jego atomie elektron walencyjny znajduje się (bliżej jądra / dalej od jądra) niż elektron walencyjny w atomie sodu. Oznacza to, że (łatwiej / trudniej) oderwać elektron walencyjny atomu potasu niż elektron walencyjny atomu sodu. 2. Wartość pierwszej energii jonizacji atomu magnezu jest (niższa / wyższa) niż wartość pierwszej energii jonizacji atomu glinu, gdyż łatwiej oderwać pojedynczy elektron z niecałkowicie obsadzonej podpowłoki (s / p / d) niż elektron z całkowicie obsadzonej podpowłoki (s / p / d).
KOREPETYCJE