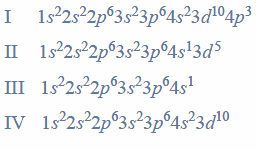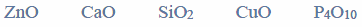Właściwości chlorku wapnia, etanolu, kwasu etanowego, kwasu solnego i zasady potasowej.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Poniżej podano wzory pięciu rozpuszczalnych w wodzie związków chemicznych.


Wypełnij tabelę – wpisz numery, którymi oznaczono wzory wszystkich związków wykazujących podane w tabeli właściwości.
Pary kwas-zasada. Teoria Bronsteda.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Dane są wzory sześciu cząsteczek i jonów:
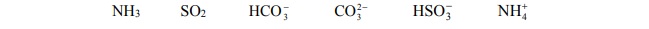
Spośród wymienionych powyżej wzorów wybierz i wpisz do tabeli wzory tych drobin,
które zgodnie z teorią Brønsteda stanowią sprzężone pary kwas–zasada.

Właściwości chemiczne berylu, reakcje berylu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej
przedstawiono schemat reakcji berylu z kwasem i zasadą.
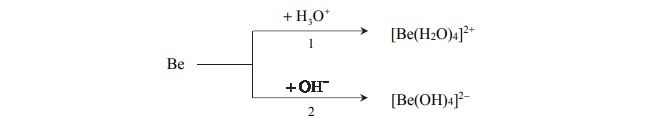
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2,
wiedząc, że jednym z produktów obu przemian jest ten sam gaz. Uwzględnij tworzenie się
kompleksowych jonów berylu.
Równanie reakcji 1:
Równanie reakcji 2:
Produktem spalania sodu w tlenie jest nadtlenek tego metalu o wzorze Na2O2
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Produktem spalania sodu w tlenie jest nadtlenek tego metalu o wzorze Na2O2 (reakcja 1.).
Do wody z dodatkiem kilku kropli fenoloftaleiny wprowadzono nadtlenek sodu. Przebiegła
gwałtowna reakcja, w wyniku której powstał m.in. nadtlenek wodoru, a roztwór zabarwił się
na malinowo (reakcja 2.). Następnie do otrzymanej mieszaniny dodano wodny roztwór kwasu
siarkowego(VI), czego skutkiem stało się odbarwienie roztworu (reakcja 3.). Otrzymany
roztwór ogrzano, co doprowadziło do wydzielenia bezbarwnego i bezwonnego gazu, który
podtrzymuje palenie (reakcja 4.).
Napisz w formie cząsteczkowej równania czterech opisanych przemian.
Równanie reakcji 1.:
Równanie reakcji 2.:
Równanie reakcji 3.:
Równanie reakcji 4.:
Wartości promieni atomowych pierwiastków
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
We fragmencie układu okresowego pierwiastków podano wartości promieni atomowych wybranych pierwiastków.
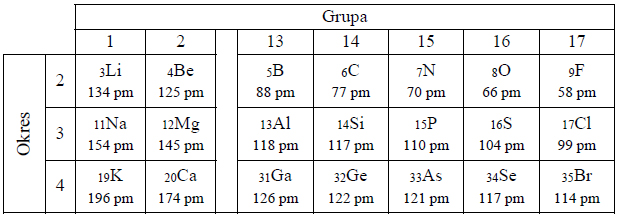
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2006.
Wyjaśnij przyczynę zmian wielkości promienia atomowego pierwiastków w okresach i grupach układu okresowego.
W danym okresie wraz ze wzrostem liczby atomowej wielkość promienia atomowego (rośnie / maleje), a spowodowane to jest ………………………………………………………………….
W danej grupie wraz ze wzrostem liczby atomowej wielkość promienia atomowego (rośnie / maleje), a spowodowane to jest ………………………………………………………………………
Reakcja tlenku żelaza (III) z tlenkiem węgla (II)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
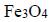
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.
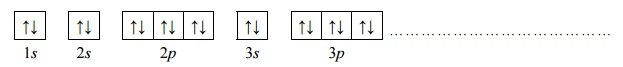
Konfiguracja elektronów kationu żelaza.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
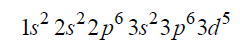

Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
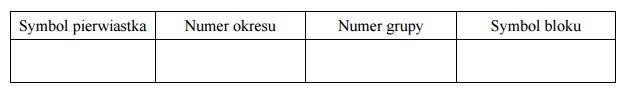
Określanie położenia w układzie okresowym na podstawie elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Konfiguracja elektronów uczestniczących w tworzeniu wiązań atomu pierwiastka Z jest następująca:
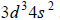
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka Z, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy ten pierwiastek.
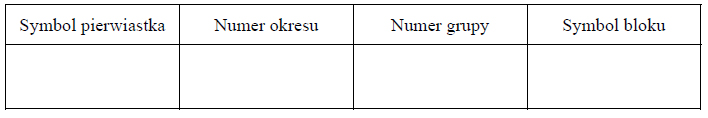
Przemysłowa produkcja żelaza. Tlenek żelaza (II, III)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Pierwszy etap przemysłowej produkcji żelaza w wielkim piecu polega na reakcji tlenku żelaza(III) z tlenkiem węgla(II) z utworzeniem
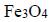
i gazowego produktu utleniania tlenku węgla(II) (etap 1.). Następnie, w etapie 2., otrzymany tlenek żelaza, w którym żelazo występuje na dwóch różnych stopniach utlenienia, poddaje się reakcji z tlenkiem węgla(II), w wyniku czego powstają metaliczne żelazo oraz ten sam gazowy produkt, który powstawał w etapie 1.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz w formie cząsteczkowej równania reakcji etapu 1. i etapu 2. przemysłowego procesu otrzymywania żelaza w wielkim piecu.
Rozpoznawanie pierwiastka na podstawie konfiguracji elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej maj 2017 stara formuła
Dwa pierwiastki umownie oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz ten pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
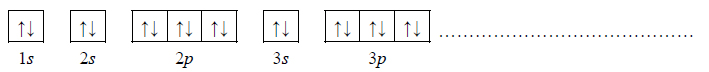
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
– atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
– atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
1. Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.

2. Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
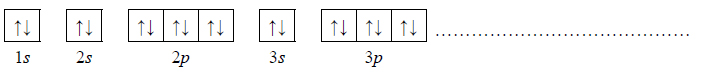
3. Napisz wzór sumaryczny wodorku pierwiastka X oraz wzór sumaryczny tlenku pierwiastka Z, w którym ten pierwiastek przyjmuje maksymalny stopień utlenienia.