Reakcje utleniania i redukcji
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
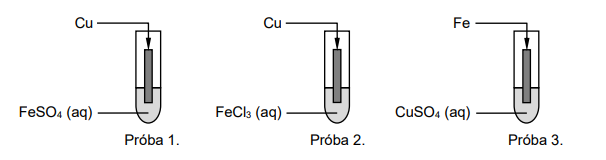
Wróć do listyTwoim zadaniem będzie zbadanie zachowania się jonów żelaza(II) i żelaza(III) wobec metalicznej miedzi oraz jonów miedzi(II) wobec metalicznego żelaza.
Poniżej przedstawiono wybrane równania procesów utleniania-redukcji, którym ulegać mogą badane jony i metale, oraz wartości potencjałów standardowych dla wymienionych par redoks.
Fe²⁺ (aq) + 2e⁻ ⇄ Fe (s) – 0,44 V
Fe³⁺ (aq) + e⁻ ⇄ Fe²⁺ (aq) 0,77 V
Fe³⁺ (aq) + 3e⁻ ⇄ Fe (s) – 0,04 V
Cu⁺(aq) + e⁻ ⇄ Cu (s) 0,52 V
Cu²⁺ (aq) + e⁻ ⇄ Cu⁺(aq) 0,15 V
Cu²⁺ (aq) + 2e⁻ ⇄ Cu (s) 0,34 V
Dla każdego przygotowanego układu sformułuj hipotezę (zaznacz TAK albo NIE) dotyczącą możliwości zajścia reakcji w próbach 1.–3. Następnie przeprowadź opisane próby, zapisz obserwacje, oceń prawdziwość hipotezy, sformułuj wnioski i napisz równanie reakcji (jeżeli reakcja zachodzi).
Próba 1.

Ocena hipotezy i wnioski:
Równanie reakcji:
Próba 2.

Ocena hipotezy i wnioski:
Równanie reakcji:
Próba 3.

Ocena hipotezy i wnioski:
Równanie reakcji:

KOREPETYCJE