Zadanie 126.
2015 zbiór CKE
Wróć do listySiarkowodór otrzymywany jest w laboratorium w reakcji kwasu solnego z siarczkiem żelaza(II). Reakcja ta przebiega zgodnie z równaniem:
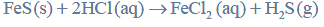
Tak otrzymany gazowy siarkowodór wykorzystuje się w analizie chemicznej do wytrącania osadów trudno rozpuszczalnych siarczków, np. siarczku cynku. Gdy wodny roztwór, w którym znajdują się jony cynku, nasyca się siarkowodorem, zachodzi reakcja opisana równaniem:
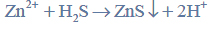
Po zakończeniu reakcji biały osad siarczku cynku odsącza się na sączku z bibuły, przemywa i umieszcza wraz z sączkiem w uprzednio zważonym porcelanowym tyglu. Następnie spala się sączek i praży osad w temperaturze 900 ºC aż do uzyskania stałej masy. Podczas prażenia osad siarczku cynku przechodzi w tlenek cynku zgodnie z równaniem:
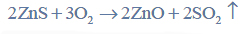
Znając masę otrzymanego tlenku cynku, można obliczyć masę cynku, który znajdował się w badanym roztworze.
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Chemiczne metody analizy ilościowej, t. 2, Warszawa 1998, s. 174–175.
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym rysunku.
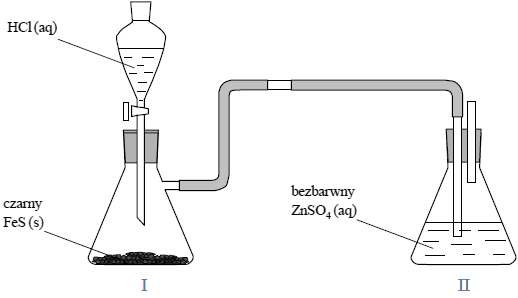
Napisz, jakie zmiany zaobserwowano w czasie doświadczenia w kolbie I i II.
KOREPETYCJE