interpretacja jakościowej i ilościowej równania reakcji w ujęciu molowym
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wróć do listyReakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
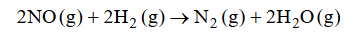
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:2
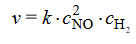
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, CNO CH₂ oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości
k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole wodoru. Podczas reakcji utrzymywano stałą temperaturę.
Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.

KOREPETYCJE