obliczenia z uwzględnieniem wydajności reakcji i mola
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wróć do listyReakcja tlenku węgla(II) z parą wodną przebiega zgodnie z równaniem:
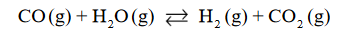
W temperaturze 800 K stężeniowa stała równowagi tej reakcji jest równa 4,0.
W zamkniętym reaktorze o stałej pojemności zmieszano 1 mol tlenku węgla(II) z parą wodną w ilości trzykrotnie większej od ilości stechiometrycznej. Mieszaninę utrzymywano w temperaturze 800 K aż do osiągnięcia stanu równowagi dynamicznej przez układ
Oblicz liczbę moli każdej substancji znajdującej się w reaktorze po ustaleniu się stanu równowagi opisanej reakcji.

KOREPETYCJE