Próbkę X pewnego preparatu, którego głównym składnikiem jest witamina C, rozpuszczono w wodzie, w wyniku czego otrzymano 100,0 cm3roztworu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Wróć do listyZawartość kwasu askorbinowego w próbce wyznacza się na podstawie stechiometrii jego
reakcji z jodem. Do roztworu zawierającego nieznaną ilość kwasu askorbinowego i niewielką ilość skrobi dodaje się kroplami roztwór jodu w roztworze jodku potasu. Stężenie roztworu jodu musi być dokładnie znane, a jego objętość – mierzona. Mówimy, że roztwór kwasu askorbinowego miareczkuje się roztworem jodu. Dopóki kwas askorbinowy jest obecny w roztworze, zachodzi reakcja, którą można w uproszczeniu opisać równaniem:
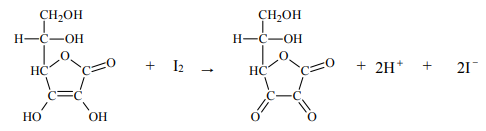
Gdy cały kwas askorbinowy przereaguje, jod dostarczony w nadmiarowej kropli poskutkuje zabarwieniem skrobi. W tym momencie kończy się miareczkowanie, co oznacza, że osiągnięto punkt końcowy i należy odczytać objętość zużytego roztworu jodu. Gdy zna się jego stężenie, można obliczyć, ile kwasu askorbinowego zawierała próbka.
Próbkę X pewnego preparatu, którego głównym składnikiem jest witamina C, rozpuszczono w wodzie, w wyniku czego otrzymano 100,0 cm3
roztworu. Następnie pobrano 10,0 cm3 tego roztworu, przeniesiono do kolby i miareczkowano roztworem jodu o stężeniu 0,052 3 mol dm− ⋅ . Stwierdzono, że punkt końcowy miareczkowania został osiągnięty po dodaniu 10,8 cm3 roztworu jodu.
Oblicz w miligramach zawartość witaminy C w próbce X, jeśli wiadomo, że pozostałe składniki preparatu nie reagują z jodem. Przyjmij, że masa molowa witaminy C jest równa M = 176 g·mol–1.
KOREPETYCJE