Przykład buforu – mieszanina roztworu octanu sodu i roztworu kwasu octowego
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyRoztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga
chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
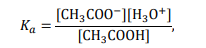
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
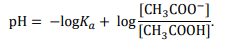
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
1. Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
HCl
NaOH
NH4Cl
NaCl
2. Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm−3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm−3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.

KOREPETYCJE