mieszanina dwóch słabych kwasów jednoprotonowych
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyW praktyce analitycznej stosuje się roztwory zawierające mieszaninę dwóch kwasów lub zasad. Jeżeli roztwór zawiera mieszaninę dwóch słabych kwasów jednoprotonowych, można przyjąć z pewnym przybliżeniem, że stężenie jonów hydroniowych w tym roztworze jest równe:
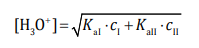
gdzie:
KaI i KaII – stałe dysocjacji kwasów
cI i cII – stężenia kwasów w otrzymanej mieszaninie.
W temperaturze T zmieszano 50,0 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 0,10 mol · dm–3 z 50,0 cm3 wodnego roztworu kwasu etanowego (octowego) o stężeniu 0,10 mol · dm–3 . W temperaturze T stała dysocjacji kwasu metanowego jest równa 1,77 · 10–4, a stała dysocjacji kwasu etanowego wynosi 1,75 · 10–5.
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.

KOREPETYCJE