Zadanie 4
2018 MAJ PODSTAWA
Wróć do listyZadanie 4. (1 pkt)
Elektrony w atomach są przyciągane przez jądro, więc usunięcie elektronu z powłoki wymaga
nakładu energii, która jest nazywana energią jonizacji. Pierwsza energia jonizacji
to minimalna energia potrzebna do oderwania jednego elektronu od atomu.
Poniżej podane są wartości pierwszej energii jonizacji litu, sodu i rubidu.
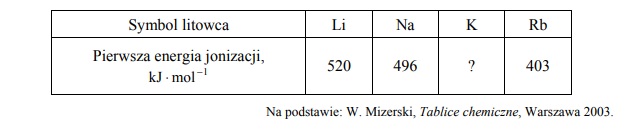
Uzupełnij poniższe zdania, tak aby otrzymane informacje były prawdziwe.
Lit ma (niższą / wyższą) wartość pierwszej energii jonizacji niż sód, ponieważ w jego atomie
elektron walencyjny znajduje się (bliżej jądra / dalej od jądra) niż elektron walencyjny
w atomie sodu. Im mniejszy jest promień atomu litowca, tym (mniejsza / większa) jest
energia potrzebna do oderwania elektronu od atomu. Pierwsza energia jonizacji potasu jest
równa (510 / 419 / 376) 1 kJ mol − ⋅ .
KOREPETYCJE