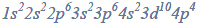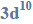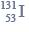Zadanie 1.
2005 czerwiec
Zapisz pełną konfigurację elektronową atomu chromu i atomu cynku w stanie podstawowym.
Rozkład promieniotwórczy polonu.
Arkusz maturalny z chemii rozszerzonej maj 2005
Polon ulega przemianie α. Okres połowicznego rozpadu tego izotopu wynosi 138 dni.
W pojemniku umieszczono 1 gram polonu Po. Oszacuj masę tego izotopu, która pozostanie po upływie 414 dni.
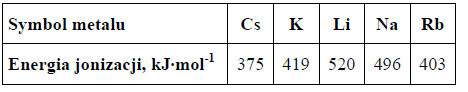
Dwa pierwiastki oznaczono umownie literami X i Z.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma
konfigurację elektronową 1s2 2s2 2p6 3s2 3p6 w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16. Cząsteczka tego związku ma budowę liniową.
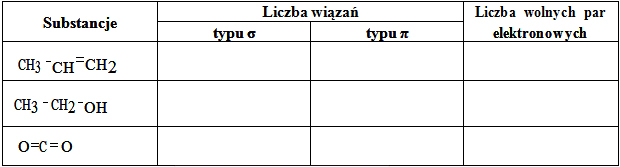
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego.
Wzór sumaryczny: ……………………………….. Typ hybrydyzacji: ………………………………..
Liczba wiązań typu σ: …………………………… Liczba wiązań typu π: …………………………..
W kryształach metalicznych sieć krystaliczna zbudowana jest…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Uzupełnij poniższe zdania dotyczące czterech różnych rodzajów kryształów. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
W kryształach metalicznych sieć krystaliczna zbudowana jest z (atomów /
cząsteczek / kationów i anionów / kationów metali) otoczonych chmurą zdelokalizowanych elektronów. Elementami, z których zbudowana jest sieć krystaliczna tlenku wapnia, są (atomy / cząsteczki / kationy i aniony). W kryształach molekularnych dominują oddziaływania międzycząsteczkowe, a w kryształach kowalencyjnych atomy tworzące sieć krystaliczną połączone są wiązaniami kowalencyjnymi. Przykładem kryształu molekularnego jest kryształ (chlorku sodu / sacharozy / wapnia), a przykładem kryształu kowalencyjnego – kryształ (diamentu / jodu / węglanu wapnia).