Przeprowadzono doświadczenie, podczas którego do 10 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami wodny roztwór pewnego elektrolitu o stężeniu

mierząc pH mieszaniny reakcyjnej. Przebieg doświadczenia zilustrowano schematem.
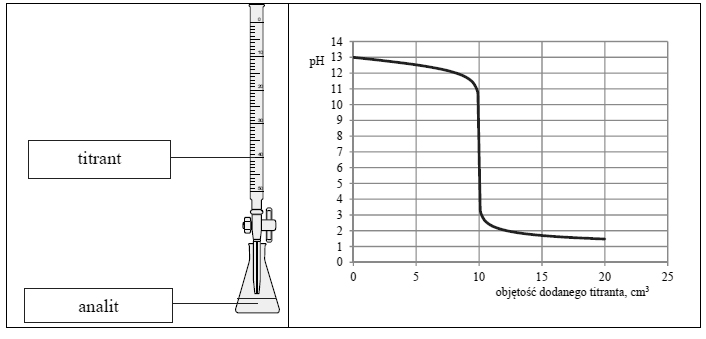
Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się stechiometryczną zależność między substancjami obecnymi w analicie i titrancie.
Odczytana z wykresu wartość pH roztworu otrzymanego po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów jest równa 7.
Aby roztwór przewodził prąd elektryczny, muszą być w tym roztworze obecne jony. Im większa jest ich ruchliwość, tym przewodnictwo jest większe. Dwa najbardziej ruchliwe jony to kationy wodorowe (H+ ) i aniony wodorotlenkowe (OH− ). Ruchliwość innych jonów jest znacznie mniejsza.
Na podst.: M. Sienko, R. Plane, Chemia, Warszawa 1996 oraz L. Pajdowski, Chemia ogólna, Warszawa 1982.
Gdy analizuje się ruchliwość jonów obecnych w roztworze w danym momencie opisanego miareczkowania, można przewidzieć, jak zmienia się jego przewodnictwo (inne czynniki można tu pominąć).
Zaznacz poprawne dokończenie zdania.W miarę dodawania titranta do wodnego roztworu wodorotlenku soduA. zarówno pH, jak i przewodnictwo roztworu rosną.B. pH roztworu rośnie, a przewodnictwo roztworu maleje.C. pH roztworu maleje, a przewodnictwo najpierw maleje, a potem rośnie.D. pH roztworu maleje, a przewodnictwo najpierw rośnie, a potem maleje.