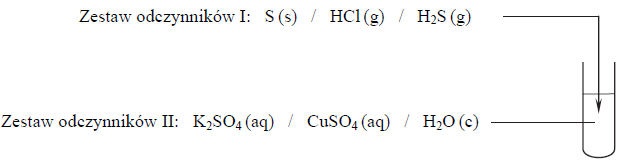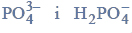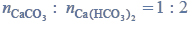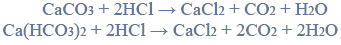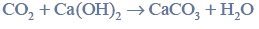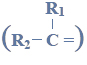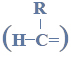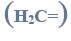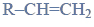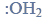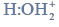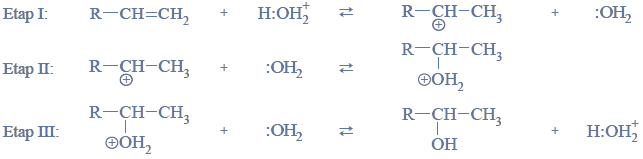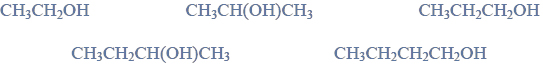Redukcja aldehydu.
Arkusz maturalny z chemii rozszerzonej maj 2016 nowa formuła
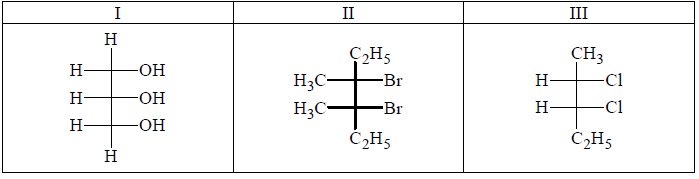
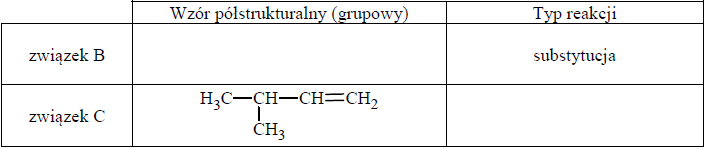
Przeprowadzono ciąg przemian opisany poniższym schematem.
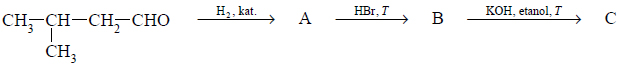
Napisz równanie reakcji prowadzącej do otrzymania produktu A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Izomeria geometryczna aldehydu
Arkusz maturalny z chemii rozszerzonej maj 2016 nowa formuła
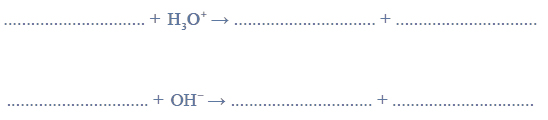
Aldehyd cynamonowy to związek o wzorze:
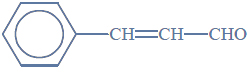
Aldehyd ten występuje w przyrodzie w konfiguracji trans.
Aldehyd ten występuje w przyrodzie w konfiguracji trans.
Wzór aldehydu cynamonowego.
Arkusz maturalny z chemii rozszerzonej maj 2016 nowa formuła
Aldehyd cynamonowy to związek o wzorze:

Aldehyd ten występuje w przyrodzie w konfiguracji trans.
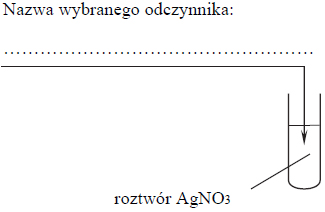
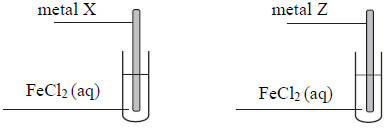
W celu zbadania właściwości aldehydu cynamonowego wykonano eksperyment, którego przebieg zilustrowano na rysunku.
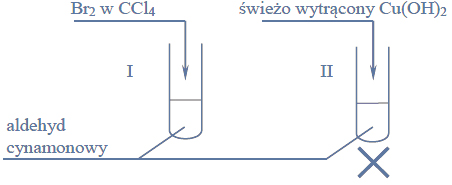
Porównaj przebieg reakcji w obu probówkach. Dokończ poniższe zdania – wybierz i podkreśl właściwe opisy spostrzeżeń spośród podanych w nawiasach.1. Po dodaniu odczynnika do probówki I zaobserwowano, że roztwór bromu (uległ odbarwieniu / zabarwił się na fioletowo / nie zmienił zabarwienia).2. W probówce II w wyniku ogrzewania zawiesiny wodorotlenku miedzi(II) z aldehydem cynamonowym powstał (szafirowy roztwór / ceglasty osad / różowy roztwór).