Heksacyjanożelazian(II) potasu- sól zawierająca jon kompleksowy
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyHeksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)₆]⁴⁻.
Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K₄Fe(CN)₆ o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K₄Fe(CN)₆. Wydajność obu reakcji wynosiła 100%.
1. Napisz równania reakcji przebiegających na anodzie i na katodzie podczas opisanego procesu wytwarzania bromu.
Anoda:
Katoda:
2. Jon heksacyjanożelazianu(II) reaguje z bromem zgodnie ze schematem:
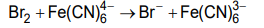
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany.
Równanie reakcji redukcji:
3. Czas trwania elektrolizy prowadzącej do otrzymania stechiometrycznej ilości bromu w stosunku do K₄Fe(CN)₆ określa się w równoległym eksperymencie – w układzie dwóch elektrod platynowych E3 oraz E4. Umieszcza się je w badanym roztworze i przykłada do nich niewielką różnicę potencjałów. Podczas eksperymentu rejestruje się natężenie prądu przepływającego w układzie pomiarowym. Na początku elektrolizy natężenie prądu wzrasta proporcjonalnie do ilości powstających jonów Fe(CN)³⁻₆. Maksymalna wartość natężenia prądu obserwowana jest w chwili, gdy liczba moli jonów Fe(CN)³⁻₆ jest równa liczbie moli jonów Fe(CN)⁴⁻₆. Następnie natężenie prądu spada prawie do zera i osiąga minimum w momenciecałkowitego przereagowania jonów Fe(CN)⁴⁻₆. W dalszym etapie elektrolizy natężenie prądu przepływającego między elektrodami E3 i E4 wzrasta.
Przeanalizuj poniższe wykresy i zaznacz ten, który odpowiada opisanym zmianom natężenia prądu przepływającego w układzie elektrod oznaczonych symbolami E3 oraz E4.
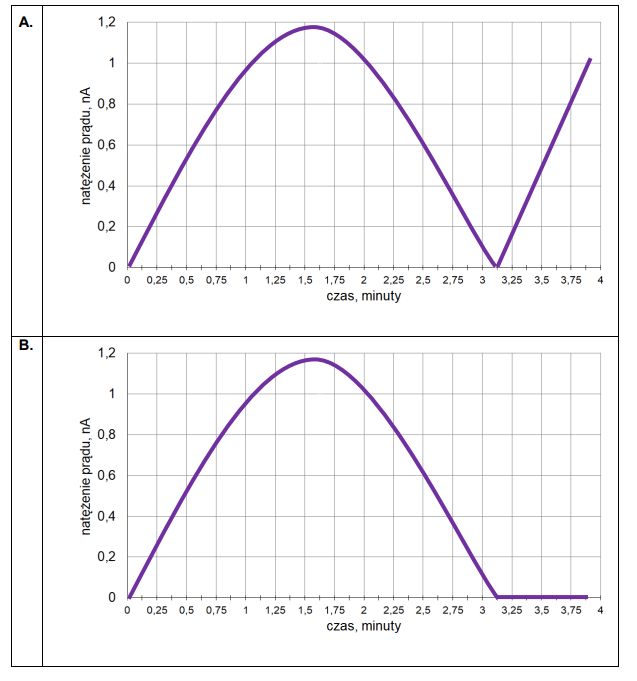
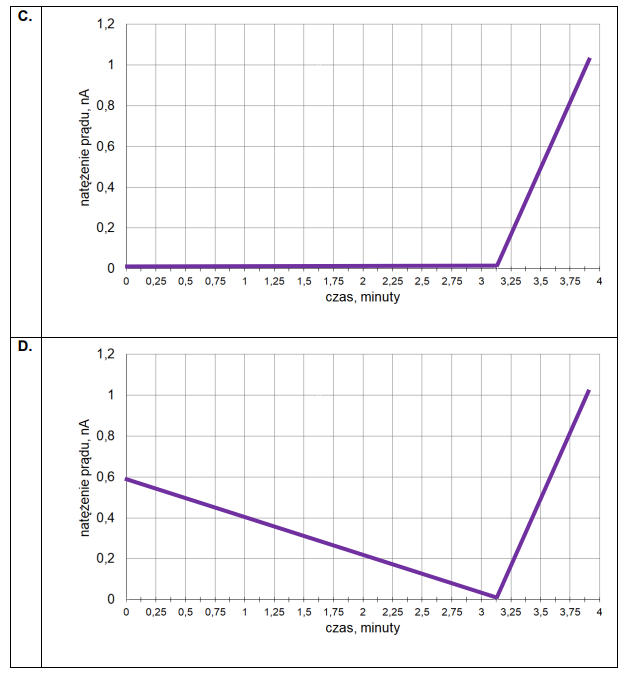
4. Liczba moli elektronów wymienionych podczas elektrolizy jest określona następującym wzorem:
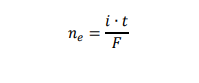
gdzie:
i – natężenie prądu, A
t – czas trwania elektrolizy, s
F – stała Faradaya, 96500 C · mol ⁻ ¹.
Oblicz liczbę moli jonów [Fe(CN)₆]⁴⁻ w badanym roztworze. Czas potrzebny do otrzymania stechiometrycznej ilości bromu odczytaj z wykresu wybranego w zadaniu 3.

KOREPETYCJE