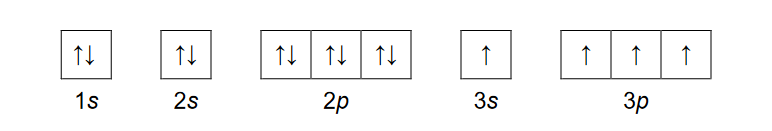
budowa atomu
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wybierz parę pierwiastków, których atomy w stanie podstawowym mają różne liczby niesparowanych elektronów. Zaznacz poprawną odpowiedź.
A. krzem i tytan
B. siarka i tytan
C. krzem i żelazo
D. siarka i nikiel
Budowa atomu – wiązania chemiczne
INFORMATOR o egzaminie maturalnym z chemii 22/23
Tlenek krzemu (SiO 2), nazywany potocznie krzemionką, jest bardzo rozpowszechniony
w przyrodzie. Czysta krzemionka występuje w postaci krystalicznej, np. jako minerał kwarc.
Poniżej przedstawiono zdjęcie kryształów kwarcu oraz model jego struktury krystalicznej.
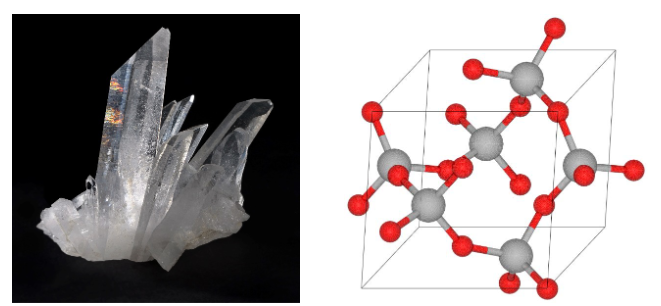
Dokończ zdanie. Zaznacz odpowiedź spośród A–D i jej uzasadnienie spośród 1.–4.
Kwarc można zaliczyć do kryształów

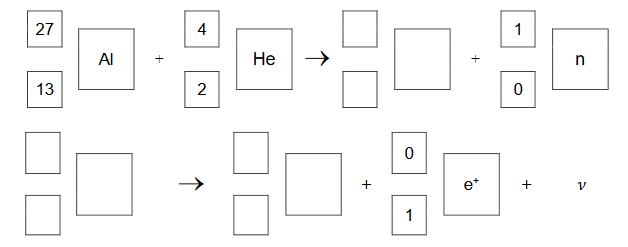
bombardowanie folii aluminiowej cząstkami alfa
INFORMATOR o egzaminie maturalnym z chemii 22/23
Podczas bombardowania folii aluminiowej cząstkami alfa zachodzą procesy jądrowe z równoczesną emisją pozytonów i neutronów. Stwierdzono, że przemiana jest dwuetapowa: w pierwszej reakcji jądrowej powstają niestabilne jądro i neutron, a potem następuje rozpad β+ tego niestabilnego jądra, któremu towarzyszy emisja neutrino ν.
Napisz równania opisanej przemiany jądrowej. Uzupełnij poniższe schematy.
Promieniotwórczość ciężkojonowa
INFORMATOR o egzaminie maturalnym z chemii 22/23
Promieniotwórczość ciężkojonowa to szczególny i rzadki rodzaj promieniotwórczości. Polega na emisji z ciężkiego jądra atomowego jąder atomów lekkiego pierwiastka. Równania takich rozpadów promieniotwórczych zapisuje się zgodnie z zasadami zachowania: ładunku elektrycznego jąder oraz liczby nukleonów.
Napisz równanie rozpadu jądra promieniotwórczego izotopu Ac 89 223 , z którego jest emitowane jądro izotopu węgla zawierające 8 neutronów.
Atom siarki i jego związki
INFORMATOR o egzaminie maturalnym z chemii 22/23
Atom siarki tworzy z atomami fluoru m.in. cząsteczki o wzorze SF2 i SF6.
1. Narysuj wzór elektronowy cząsteczki SF2 – zaznacz kreskami wspólne pary elektronowe oraz wolne pary elektronowe atomów siarki i fluoru. Określ kształt cząsteczki (liniowa, kątowa, tetraedryczna).
Wzór elektronowy:
Kształt cząsteczki:
2. Poniżej zamieszczono model ilustrujący kształt cząsteczki SF6.

Wykaż na podstawie teorii VSEPR (odpychanie par elektronowych powłoki walencyjnej), że przedstawiony model jest poprawną ilustracją kształtu cząsteczki SF6.
wpływ zmian temperatury i zmian ciśnienia w układzie na wydajność otrzymywania produktu
INFORMATOR o egzaminie maturalnym z chemii 22/23
Zbadano wpływ zmian temperatury (doświadczenie I) i zmian ciśnienia (doświadczenie II) w układzie na wydajność otrzymywania produktu X w reakcji opisanej schematem:
aA (g) + bB (g) ⇄ xX (g)
Wyniki pomiarów zamieszczono w poniższych tabelach. Zawartość produktu X w mieszaninie równowagowej wyrażono w procentach objętościowych.
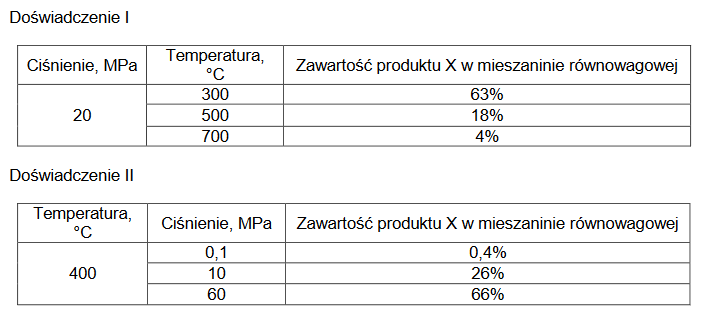
Na podstawie przedstawionych wyników pomiarów wybierz spośród wymienionych poniżej proces, który zachodził w badanym układzie. Napisz numer wybranego procesu. Odpowiedź uzasadnij.

Numer procesu:
Uzasadnienie:
Obserwacja zmian energii wewnętrznej układu w wyniku przemiany chemicznej
INFORMATOR o egzaminie maturalnym z chemii 22/23
Przeprowadzono doświadczenie, którego celem była obserwacja zmian energii wewnętrznej badanego układu w wyniku przemiany chemicznej. W procesie przeprowadzonym w warunkach izotermiczno-izobarycznych wprowadzono do cylindra gazowy tlen oraz sproszkowane żelazo i zamknięto ten cylinder ruchomym tłokiem. Schemat doświadczenia przedstawiono na poniższym rysunku.
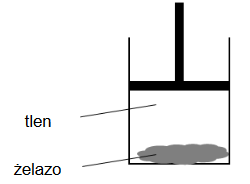
W warunkach doświadczenia reakcja zachodziła z niewielką szybkością. Ścianki cylindra umożliwiały wymianę ciepła z otoczeniem.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W wyniku przebiegu opisanego procesu tlen się zużywa, a tłok przesuwa się (w dół / w górę), wykonując pracę nad układem. Przemianie żelaza w tlenek żelaza(III) towarzyszyło odprowadzenie ciepła do otoczenia, co oznacza, że ta reakcja jest procesem (endoenergetycznym / egzoenergetycznym).
Reakcja rozkładu azotanu(V) ołowiu(II)
Informator o egzaminie maturalnym z biologii - 2022/23
Reakcja rozkładu azotanu(V) ołowiu(II) jest procesem endoenergetycznym i przebiega zgodnie z równaniem:
2Pb(NO 3) 2 → 2PbO + 4NO 2↑ + O 2↑
Wartości standardowych entalpii tworzenia związków biorących udział w opisanej reakcji podano w poniższej tabeli.

Oblicz, ile energii na sposób ciepła należy dostarczyć, aby całkowicie rozłożyć 3,31 g Pb(NO 3)2.
Wykres zmian stężeń reagentów w czasie
INFORMATOR o egzaminie maturalnym z chemii 22/23
Do reaktora o stałej pojemności, z którego usunięto powietrze, wprowadzono próbkę gazowego związku A i zainicjowano reakcję. W zamkniętym reaktorze ustaliła się równowaga opisana równaniem:
A (g) ⇄ 2B (g)
Mierzono stężenie związku A w czasie trwania reakcji. Tę zależność przedstawiono na poniższym wykresie:
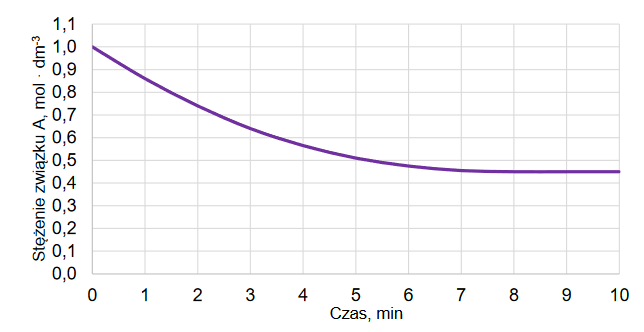
Z poniższych wykresów wybierz ten, który jest ilustracją zależność stężenia związku B od czasu trwania reakcji. Zaznacz wykres A, B, C albo D i uzasadnij swój wybór.
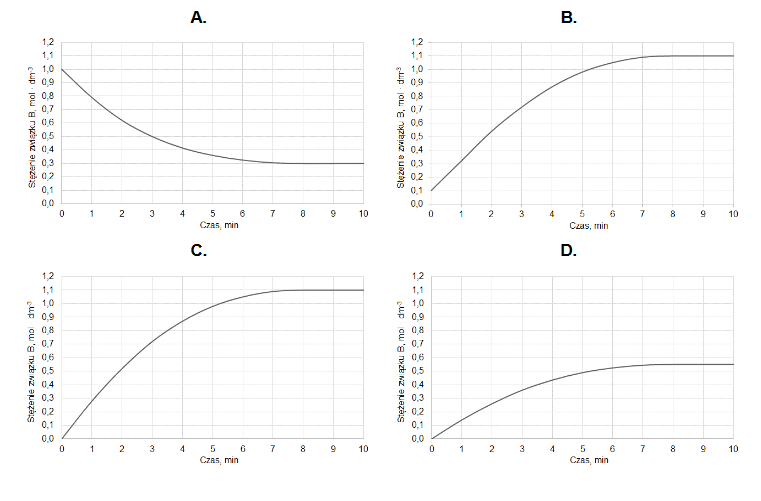
Uzasadnienie:
Reakcje w probówkach i zmiana kolorów po dodaniu odczynników
INFORMATOR o egzaminie maturalnym z chemii 22/23
Przeprowadzono doświadczenie, w którym na podstawie zachodzącej reakcji chemicznej można stwierdzić, że wolny chlor jest silniejszym utleniaczem niż wolny brom.
1. Uzupełnij schemat przeprowadzonego doświadczenia – zaznacz po jednym wzorze odczynnika w zestawach I i II.

2. Do probówki zawierającej kilka cm3 bezbarwnego rozpuszczalnika CHCl3 wlano podobną objętość odczynnika, który został wybrany z zestawu I, a następnie zawartość probówki energicznie wstrząsano. Zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 1.). Następnie do probówki dodano odczynnik wybrany z zestawu II, ponownie wstrząsano zawartość probówki i zaobserwowano rozdzielenie się cieczy na dwie warstwy (etap 2.).
Zaznacz numer zdjęcia, na którym zilustrowany jest wynik po etapie 1., oraz numer zdjęcia przedstawiającego wynik po etapie 2. doświadczenia.

3. Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia.
wodne roztwory jodku potasu
INFORMATOR o egzaminie maturalnym z chemii 22/23
W poniższych tabelach zamieszczone są dane dotyczące wodnych roztworów jodku potasu.
Tabela 1. Zależność rozpuszczalności jodku potasu (KI) od temperatury
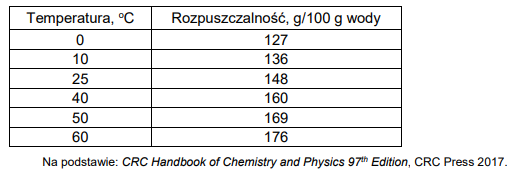
Tabela 2. Zależność gęstości roztworów jodku potasu od stężenia (t = 20 °C)
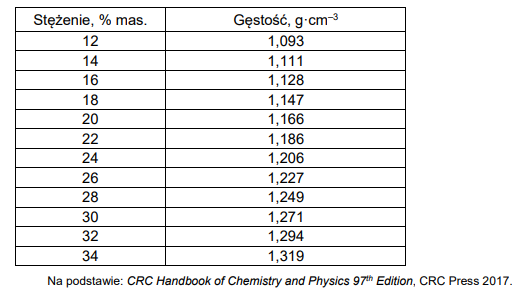
Przygotowano 100 g wodnego roztworu jodku potasu w temperaturze t = 20°C, a następnie go rozcieńczono, dodając 195 g wody i utrzymując stałą temperaturę 20°C.
Na podstawie zamieszczonych informacji narysuj wykres zależności rozpuszczalności jodku potasu od temperatury, a następnie oblicz stężenie molowe roztworu otrzymanego po zmieszaniu 100 g roztworu nasyconego i 195 g wody w temperaturze 20°C.
Obliczenia: