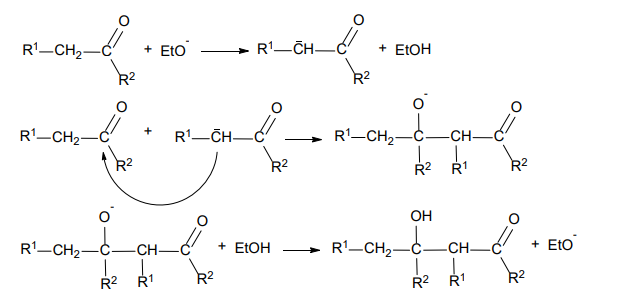
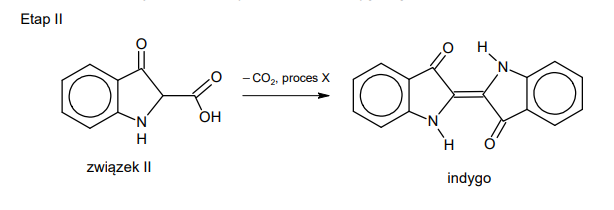
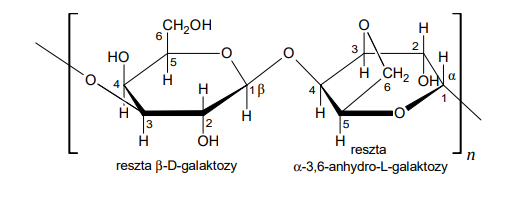
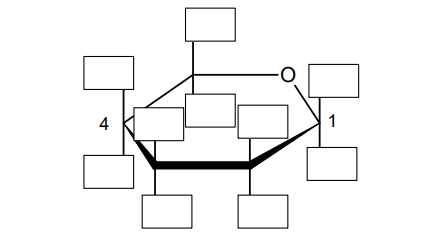
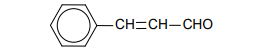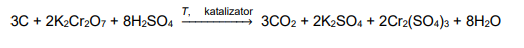Temperatury wrzenia węglowodorów
INFORMATOR o egzaminie maturalnym z chemii 22/23
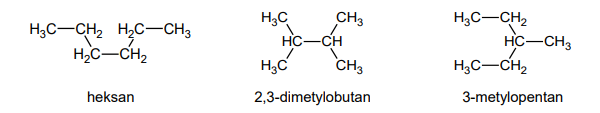
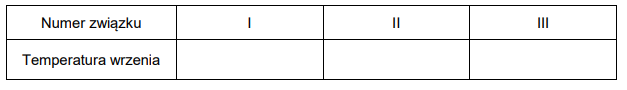
Wzory trzech związków organicznych oznaczono numerami I–III i zestawiono w poniższej tabeli. Te związki różnią się wartościami temperatury wrzenia.
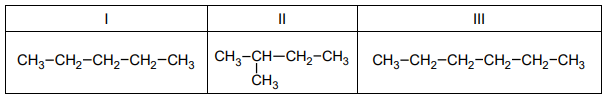
Poniżej przedstawiono – w przypadkowej kolejności – wartości temperatury wrzenia wymienionych związków (pod ciśnieniem 1013 hPa):
27,8 °C
36,1 °C
68,7 °C
Przyporządkuj każdemu związkowi charakteryzującą go temperaturę wrzenia. Uzupełnij tabelę. Podaj nazwę systematyczną związku o najwyższej temperaturze wrzenia i nazwę systematyczną związku o najniższej temperaturze wrzenia. W obu przypadkach uzasadnij swoje przyporządkowanie.
Nazwa systematyczna związku o najwyższej temperaturze wrzenia:
Uzasadnienie:
Nazwa systematyczna związku o najniższej temperaturze wrzenia:
Uzasadnienie:
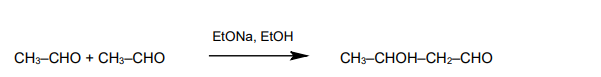
reakcja nitrowania węglowodorów
INFORMATOR o egzaminie maturalnym z chemii 22/23
Dwa węglowodory aromatyczne – A i B – mają wzór sumaryczny C₈H₁₀. Izomer A w wyniku reakcji nitrowania tworzy wyłącznie jedną mononitropochodną. Izomer B poddany reakcji monochlorowania w obecności światła, a następnie – reakcji z wodnym roztworem KOH, tworzy alkohol drugorzędowy.
1. Napisz równanie reakcji mononitrowania związku A – zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Podaj nazwę systematyczną produktu mononitrowania związku A.
Równanie reakcji:
Nazwa systematyczna produktu mononitrowania związku A:
2. Uzupełnij schemat ciągu przemian prowadzonych od związku B do alkoholu. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) albo uproszczonych.

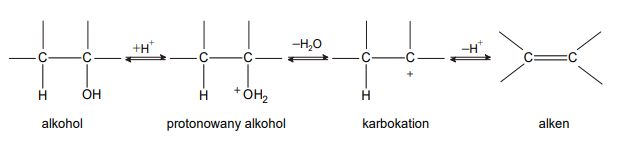
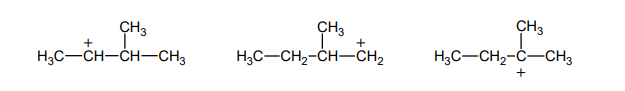
Identyfikacja alkoholi
INFORMATOR o egzaminie maturalnym z chemii 22/23
W dwóch probówkach A i B znajdują się oddzielnie dwa alkohole: 2-metylopropan-2-ol i butan-1-ol. Do obu probówek dodano wodny roztwór manganianu(VII) potasu i parę kropli wodnego roztworu kwasu siarkowego(VI). Następnie zawartość probówek dokładnie wymieszano. Po pewnym czasie od wykonania doświadczeń roztwory w próbówkach wyglądały tak jak na zdjęciach poniżej:

Podaj nazwę alkoholu, który znajdował się w probówce A. Odpowiedź uzasadnij.
Nazwa alkoholu:
Uzasadnienie:
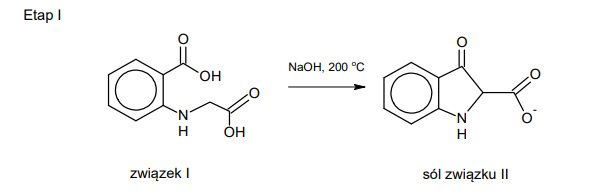
wzory Fischera stereoizomerów kwasu winowego
INFORMATOR o egzaminie maturalnym z chemii 22/23
Poniżej przedstawiono wzory Fischera trzech stereoizomerów kwasu winowego (2,3-dihydroksybutanodiowego).
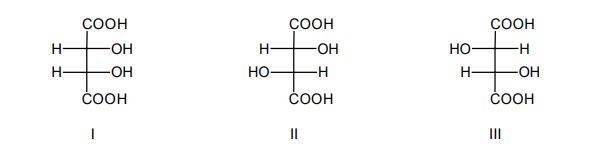
1. Uzupełnij poniższe zdanie. Wybierz i zaznacz właściwe określenie w każdym nawiasie.
Związki I i II są (enancjomerami / diastereoizomerami), a związki II i III stanowią parę (enancjomerów / diastereoizomerów).
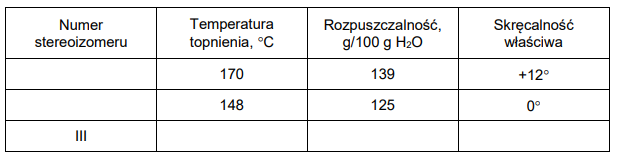
2. Wymienionym w tabeli właściwościom fizycznym substancji przyporządkuj wzory właściwych stereoizomerów (I i II) – wpisz ich numery. Dla stereoizomeru III wpisz w tabeli przewidywane wartości temperatury topnienia, rozpuszczalności
i skręcalności właściwej.
piktogramy – oznaczanie niebezpiecznych substancji i mieszanin
INFORMATOR o egzaminie maturalnym z chemii 22/23
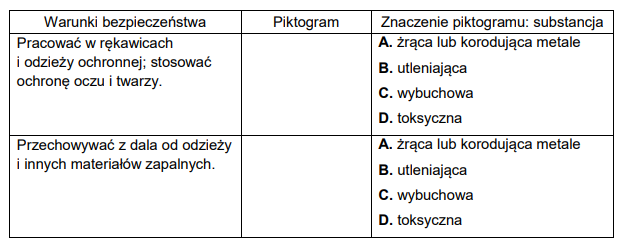
Poniżej przedstawiono wybrane piktogramy stosowane do oznaczania niebezpiecznych substancji i mieszanin.
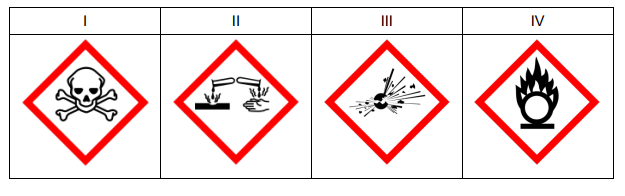
Spośród przedstawionych piktogramów wybierz dwa stosowane do opisu zagrożeń wynikających ze stosowania w laboratorium kwasu azotowego(V). Uzupełnij tabelę –
wpisz oznaczenia cyfrowe wybranych piktogramów i zaznacz literę wskazującą znaczenie danego piktogramu.
nawóz sztuczny – superfosfat
INFORMATOR o egzaminie maturalnym z chemii 22/23
Superfosfat jest nawozem sztucznym zawierającym diwodoroortofosforan(V) wapnia (Ca(H₂PO₄)₂), siarczan(VI) wapnia (CaSO₄) oraz zanieczyszczenia niezawierające wapnia i siarki. W superfosfacie zawartość procentowa siarki wynosi 11,9%, a zawartość procentowa wapnia jest równa 22,2%.
Oblicz w procentach masowych zawartość diwodoroortofosforanu(V) wapnia w superfosfacie.
chemiczna podstawa metody pokrywania karoserii samochodowych powłokami
INFORMATOR o egzaminie maturalnym z chemii 22/23
Poniżej przedstawiono opis jednej z najnowocześniejszych, a jednocześnie powszechnie stosowanej metody pokrywania karoserii samochodowych powłokami antykorozyjnymi lub dekoracyjnymi.
Do malowania wykorzystuje się farby tworzące z wodą układy koloidalne. Malowanie zachodzi w wyniku przepływu prądu elektrycznego. W polu elektrycznym obdarzone ładunkiem elektrycznym koloidalne cząstki farby poruszają się do elektrody, którą jest karoseria samochodu. Proces nakładania powłoki prowadzi się z zastosowaniem prądu stałego o określonym napięciu.
Zaznacz nazwę zjawiska stanowiącego podstawę opisanego procesu.
A. elektroliza
B. elektroforeza
C. ekstrakcja
D. sedymentacja