stężeniowa stała równowagi
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listySkład mieszaniny można wyrazić za pomocą ułamków molowych. Ułamek molowy składnika A, 𝑥𝑥𝑛𝑛(A), to iloraz liczby moli tego składnika, 𝑛𝑛A, i sumy liczb moli wszystkich składników mieszaniny. Np. dla mieszaniny trójskładnikowej A, B, C:
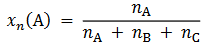
W pewnych warunkach ciśnienia i temperatury sporządzono mieszaninę dwóch gazowych substancji: wodoru i jodu, w zamkniętym reaktorze o objętości V = 20,0 dm 3.
Po zainicjowaniu procesu opisanego równaniem:
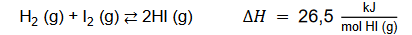
uzyskano w stanie równowagi mieszaninę o składzie: 𝑚𝑚(I 2 ) = 381 g, 𝑛𝑛(HI) = 1,50 mol oraz pewną ilość wodoru. Sumaryczna liczba moli wszystkich składników uzyskanej mieszaniny równowagowej wynosiła 6,00 moli.
1. Oblicz wartość stężeniowej stałej równowagi reakcji syntezy jodowodoru w warunkach temperatury i ciśnienia, w których wykonano pomiar, oraz oblicz skład początkowej mieszaniny substratów reakcji w ułamkach molowych.
2. Narysuj wykres przedstawiający zmiany liczby moli wszystkich reagentów w czasie trwania reakcji: od momentu rozpoczęcia eksperymentu – P, przez moment, w którym układ osiągnął stan równowagi – R, do momentu zakończenia eksperymentu – Z. W tym celu narysuj trzy krzywe obrazujące zmiany liczb moli reagentów i wprowadź oznaczenia tych krzywych: n(H2), n(I 2) oraz n(HI).
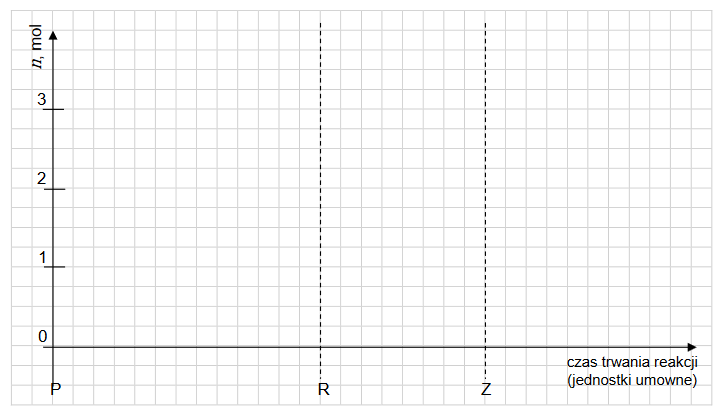
3. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.


KOREPETYCJE