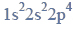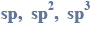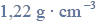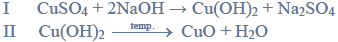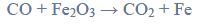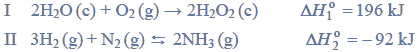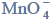Próbkę stopu glinu z magnezem o masie 10,00 gramów roztworzono w kwasie solnym.
Arkusz maturalny z chemii rozszerzonej grudzień 2013
Próbkę stopu glinu z magnezem o masie 10,00 gramów roztworzono w kwasie solnym. Podczas tego procesu przebiegły reakcje opisane równaniami:
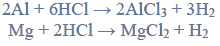
Wydzielony podczas reakcji wodór zajął objętość 11,85 dm3 (w przeliczeniu na warunki normalne).
Oblicz skład tego stopu w procentach masowych.
Wskazówki:
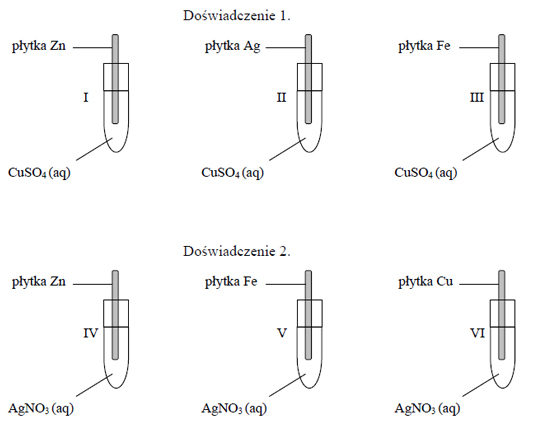
- Nie każdy metal reaguje z kwasem, szczególnie należy uważać na metale szlachetne, takie jak srebro, złoto, miedź i inne o dodatnim potencjale elektrochemicznym.
- Kwasy utleniające z metalami szlachetnymi reagują nietypowo, często popełniany błąd przez uczniów.
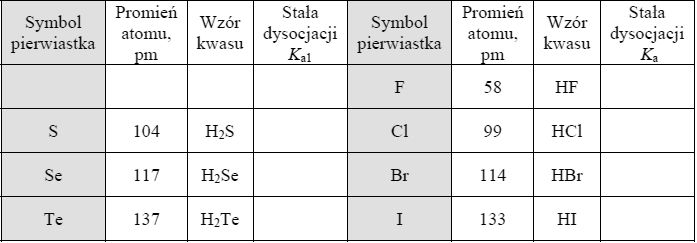
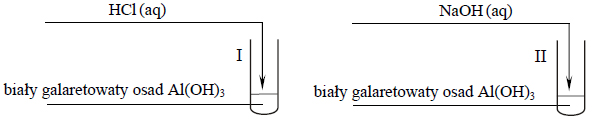
- W zadaniach z dwoma równaniami reakcji możemy spodziewać się układu równań, jednak to nie jest reguła!