Kolorymetria jest metodą stosowaną w analizie chemicznej. Dzięki niej można określić stężenie barwnego roztworu badanej substancji. Metoda ta wykorzystuje zjawisko pochłaniania przez barwny roztwór promieniowania elektromagnetycznego o określonej długości fali z zakresu światła widzialnego. Im większe jest stężenie badanej substancji w roztworze, w tym większym stopniu roztwór ten pochłania promieniowanie, a więc osłabia natężenie promieniowania przepuszczanego przez roztwór. Osłabienie to można zmierzyć, a jego miarą jest wielkość zwana absorbancją. Jeżeli serię pomiarów absorbancji roztworów badanej substancji w danym rozpuszczalniku przeprowadza się w tych samych warunkach, umieszczając próbki roztworów w identycznych naczynkach, wartości absorbancji zależą tylko od stężenia tych roztworów.
Jednym z zastosowań metody kolorymetrycznej jest oznaczanie stężenia jonów żelaza(III), które z jonami tiocyjanianowymi SCN– tworzą jony kompleksowe
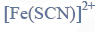
Jony te obecne w roztworze wodnym nadają mu intensywne krwistoczerwone zabarwienie, umożliwiające wykrycie nawet śladowych ilości żelaza.
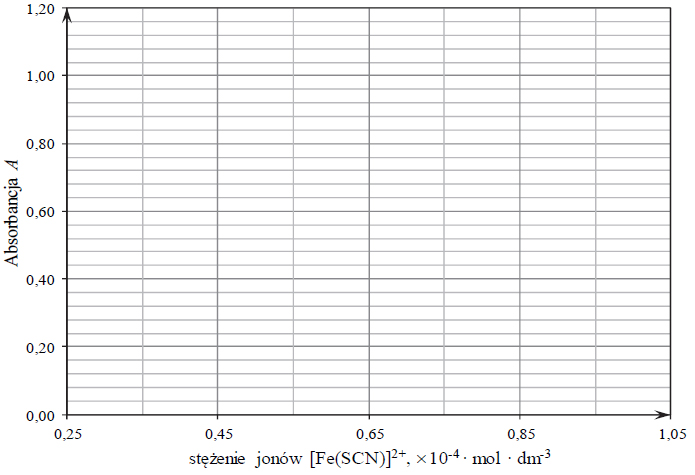
W celu wyznaczenia zawartości żelaza w postaci jonów żelaza(III) w badanym roztworze przeprowadzono opisane poniżej doświadczenie. Wykonano pomiar absorbancji A trzech wodnych roztworów o znanym stężeniu jonów
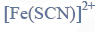
umieszczając je w identycznych naczynkach. Wyniki pomiarów zestawiono w tabeli.
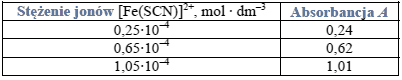
Próbkę 10,00 cm3 badanego roztworu umieszczono w kolbie miarowej o pojemności 50,00 cm3 i do kolby dodano w nadmiarze bezbarwny wodny roztwór tiocyjanianu potasu KSCN tak, aby powstał kompleks
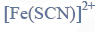
Zawartość kolby dopełniono do kreski wodą destylowaną i dokładnie wymieszano. Następnie pobrano z niej próbkę i zmierzono jej absorbancję w takich samych warunkach, w jakich wykonano wcześniejszy pomiar absorbancji roztworów o znanym stężeniu. Zmierzona absorbancja A próbki badanego roztworu wyniosła 0,44.
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, t. 2, Warszawa 2007, s. 301–302; A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010, s. 963.
a) Narysuj wykres zależności absorbancji A roztworów o znanym stężeniu i oszacuj wartość stężenia jonów
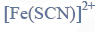
w badanym roztworze.
b) Oblicz, ile mikrogramów (μg) żelaza w postaci jonów żelaza(III) zawierała początkowa próbka badanego roztworu o objętości 10 cm3.