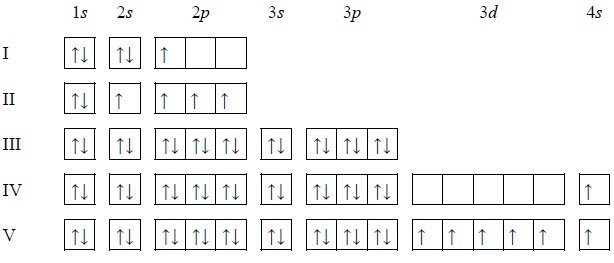
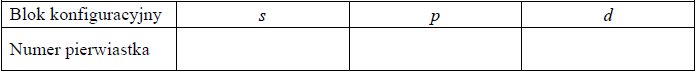
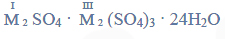
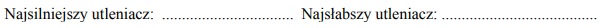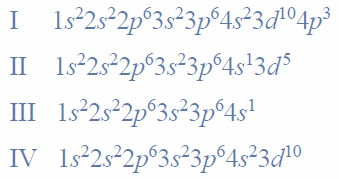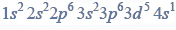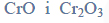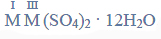Równania procesu redukcji i procesu utleniania. Siarczan (VI) manganu (II), siarczan (IV) potasu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
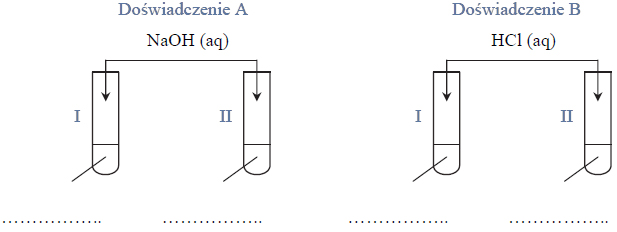
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
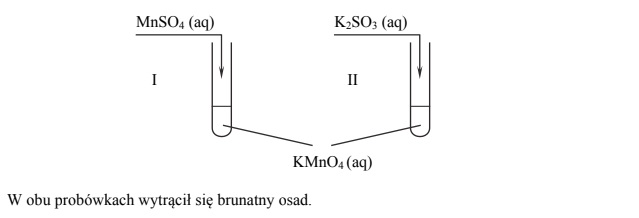
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu po reakcji w probówce I:
Nazwa anionu zawierającego siarkę:
Do probówki ze stałym etanianem sodu dodano kwas siarkowy (VI)
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła

Napisz, czy użycie do przeprowadzenia opisanego doświadczenia kwasu
ortofosforowego(V) zamiast kwasu siarkowego(VI) pozwoli na zaobserwowanie podobnych efektów.
Tworzenie się jonów kompleksowych berylu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej przedstawiono schemat reakcji berylu z kwasem i zasadą.
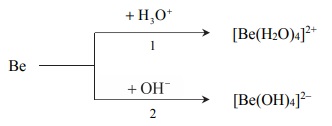
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2, wiedząc, że jednym z produktów obu przemian jest ten sam gaz. Uwzględnij tworzenie się kompleksowych jonów berylu.
Równanie reakcji 1:
Równanie reakcji 2:
Barwy jonów chromu i żelaza
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Przeprowadzono doświadczenia, których przebieg zilustrowano na schemacie:
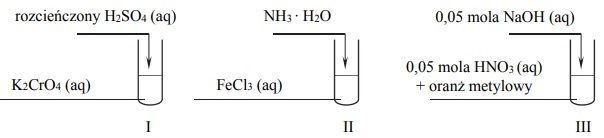
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

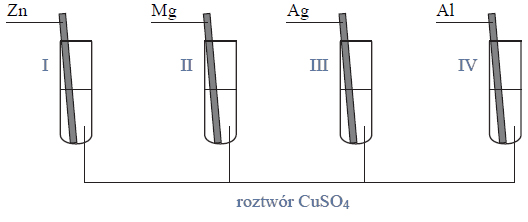
Aktywność chemiczna metali talu, technetu, hafnu i molibdenu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:

Uszereguj wymienione metale według malejącej aktywności chemicznej – napisz ich symbole w odpowiedniej kolejności.

Zadanie 18.2. (0–1)
Spośród kationów biorących udział w opisanych reakcjach wybierz jon, który jest
najsilniejszym utleniaczem, i jon, który jest najsłabszym utleniaczem. Napisz wzory
wybranych jonów.