Pierwiastki X i Z leżą w czwartym okresie układu okresowego.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem, natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek Z występuje w postaci dwuatomowych cząsteczek.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Oblicz masę mx drugiego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz masę atomową mx drugiego izotopu galu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.

Oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu, który ma mniejszą masę atomową.

Tworzenie się jonów kompleksowych berylu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej przedstawiono schemat reakcji berylu z kwasem i zasadą.
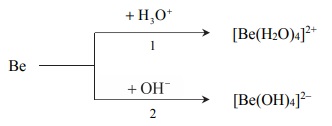
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2, wiedząc, że jednym z produktów obu przemian jest ten sam gaz. Uwzględnij tworzenie się kompleksowych jonów berylu.
Równanie reakcji 1:
Równanie reakcji 2:
Efekty energetyczny reakcji tlenku węgla(IV) z węglem
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
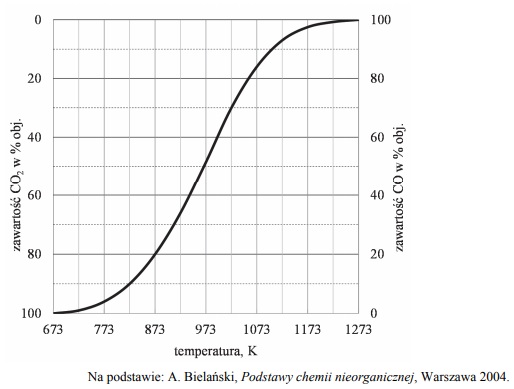
Oceń, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem endo- czy egzoenergetycznym. Odpowiedź uzasadnij.
Zawartość procentowa tlenu w mieszaninie.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
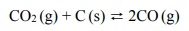
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

Oblicz wyrażoną w procentach masowych zawartość tlenu, wchodzącego w skład CO2 i CO, w pozostającej w równowadze mieszaninie tych związków z węglem w temperaturze 873 K i pod ciśnieniem 1013 hPa. Możesz przyjąć, że sumaryczna liczba moli gazowego substratu i gazowego produktu reakcji jest równa 1. W opisanych warunkach 1 mol gazu zajmuje objętość 71,6 dm3.

Barwy jonów chromu i żelaza
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Przeprowadzono doświadczenia, których przebieg zilustrowano na schemacie:
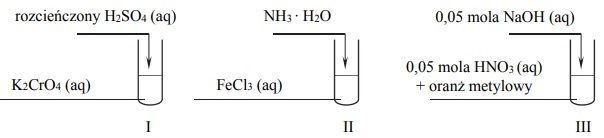
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Porówanie charakteru kwasowego fenolu, kwasu węglowego i kwasu chlorowodorowego
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
Zaprojektuj jedno doświadczenie, którym potwierdzisz, że spośród wymienionych substancji najmocniejszym kwasem jest kwas solny, a najsłabszym – fenol. W tym celu uzupełnij schemat doświadczenia. Wpisz wzory wszystkich związków, których wodnych roztworów należy użyć w doświadczeniu. Substancje wybierz spośród następujących:
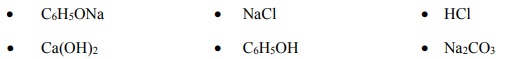
Wszystkie roztwory były świeżo przygotowane.
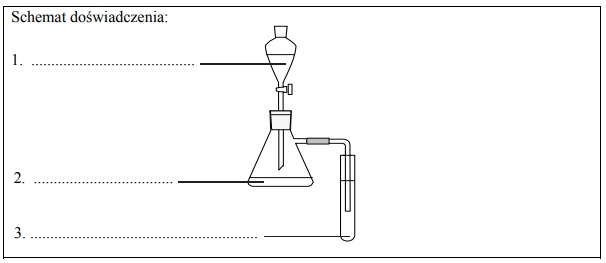
Napisz, co będzie można zaobserwować podczas przeprowadzonego doświadczenia.
Kolba:
Probówka:
Napisz w formie jonowej skróconej równania reakcji zachodzących w kolbie i w probówce podczas przeprowadzonego doświadczenia.
Równanie reakcji zachodzącej w kolbie:
Równanie reakcji zachodzącej w probówce:
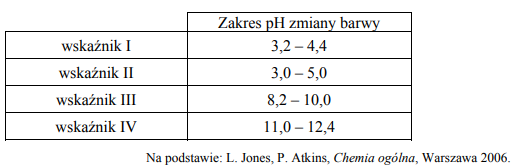
Uszereguj wodne roztwory elektrolitów zgodnie z pH
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W temperaturze T przygotowano wodne roztwory pięciu elektrolitów o jednakowym stężeniu molowym równym 0,1 3 mol dm− ⋅ . Poniżej podano wzory tych elektrolitów.
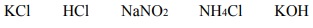
Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.

Miareczkowanie kwasu octowego roztworem zasady sodowej.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
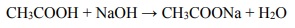
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
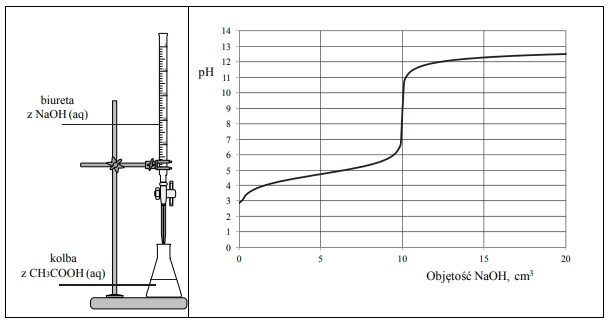
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podaj wzór jonu, którego stężenie jest największe w roztworze otrzymanym po dodaniu 18 cm3 wodnego roztworu wodorotlenku sodu do analizowanego roztworu kwasu etanowego.
Stała stężeniowa równowagi.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Dwa gazy A i B zmieszane w stosunku molowym AB: 1:4 nn = zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
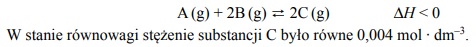
Oblicz stężeniową stałą równowagi (Kc) opisanej reakcji w temperaturze T.

Dwa gazy a i b zmieszane w stosunku molowym…
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Dwa gazy A i B zmieszane w stosunku molowym AB: 1:4 nn = zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
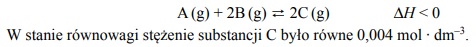
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Wskazówki
- Warunki izobaryczne to warunki w których ciśnienie układu nie ulega zmianie.
- Warunki izotermiczne to warunki w których temperatura układu nie ulega zmianie
- Reguła przekory:
Jeśli na układ znajdujący się w stanie równowagi podziała bodziec zewnętrzny, to w układzie tym zajdą przemiany prowadzące do zminimalizowania działania bodźca.
Wyjaśnienie szczegółowe można znaleźć także tutaj – link do naukowiec.org