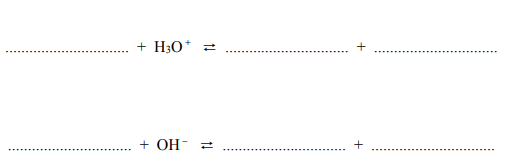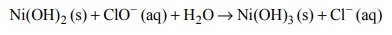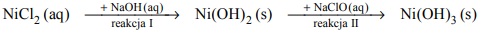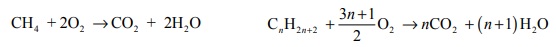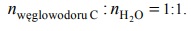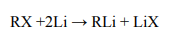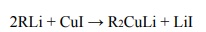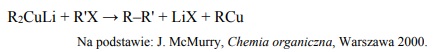Aktywność chemiczna metali talu, technetu, hafnu i molibdenu.
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
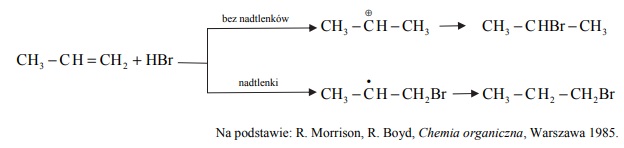
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:

Uszereguj wymienione metale według malejącej aktywności chemicznej – napisz ich symbole w odpowiedniej kolejności.

Zadanie 18.2. (0–1)
Spośród kationów biorących udział w opisanych reakcjach wybierz jon, który jest
najsilniejszym utleniaczem, i jon, który jest najsłabszym utleniaczem. Napisz wzory
wybranych jonów.
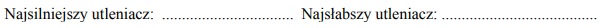
Hybrydyzacja atomów węgla w węglowodorach
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.
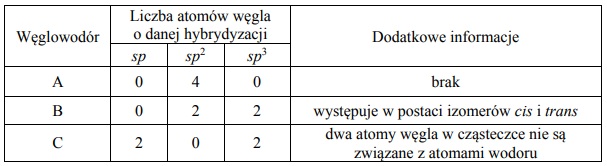
Przeprowadzono reakcję węglowodoru A z wodorem, w której stosunek molowy węglowodoru do wodoru był równy
Napisz równanie reakcji węglowodoru A z wodorem. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Homologi benzenu
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest
z siedmiu atomów węgla.
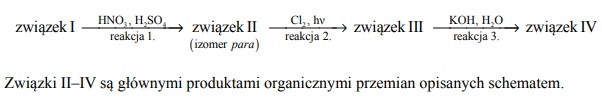
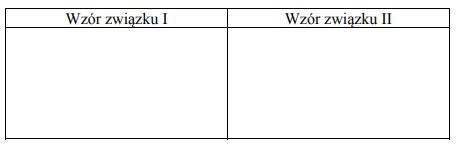
Napisz wzory półstrukturalne (grupowe) lub uproszczone związków I i II.
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 2. i 3.

Napisz w formie cząsteczkowej równanie reakcji 3. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) lub uproszczonych.