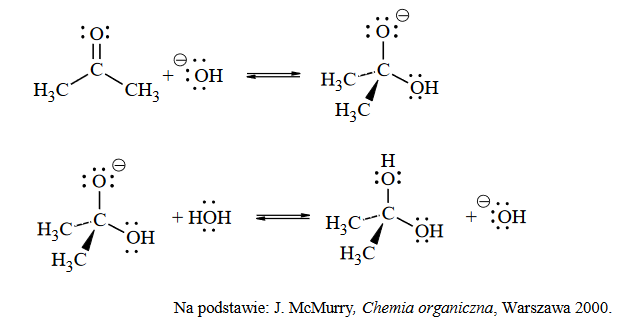
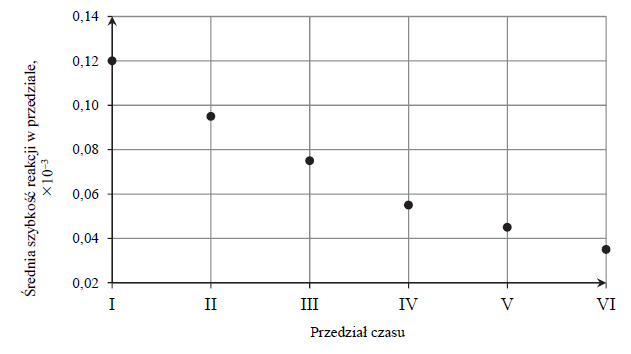
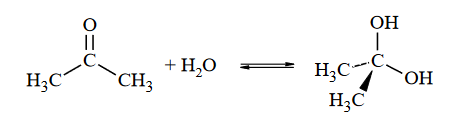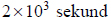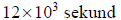zasady bilansu elektronowego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
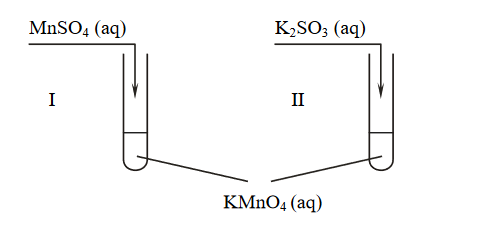
W obu probówkach wytrącił się brunatny osad.
1. Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
2. Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu poreakcji w probówce I:
Nazwa anionu zawierającego siarkę:
reakcje zachodzące w roztworach wodnych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Do probówki ze stałym etanianem (octanem) sodu dodano kwas siarkowy(VI) i zawartość naczynia ogrzano. U wylotu probówki wyczuwalny był charakterystyczny ostry zapach.
1. Napisz, czy użycie do przeprowadzenia opisanego doświadczenia kwasu ortofosforowego(V) zamiast kwasu siarkowego(VI) pozwoli na zaobserwowanie podobnych efektów.
2. W dwóch nieopisanych probówkach znajdują się wodne roztwory dwóch soli (każdy roztwór w innej probówce). Wiadomo, że jednym roztworem jest wodny roztwór etanianu (octanu) magnezu, a drugim – wodny roztwór etanianu (octanu) sodu.
Oceń, czy po dodaniu wodnego roztworu kwasu ortofosforowego(V) do obu probówek i ogrzaniu ich zawartości możliwe będzie wskazanie, w której probówce znajdował się wodny roztwór etanianu magnezu, a w której – wodny roztwór etanianu sodu. Odpowiedź uzasadnij.
Ocena:
Uzasadnienie:
kwas butanowy i jego monochloropochodne
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
W poniższej tabeli zestawiono wartości stałej dysocjacji (w temperaturze 25 ºC) kwasu butanowego i jego monochloropochodnych.
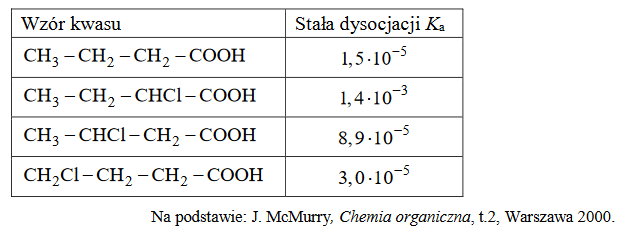
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

kwasy i zasady – klasyfikacja zgodna z teorią Brønsteda–Lowry`ego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Jon CH3COO – występujący w wodnym roztworze octanu sodu jest niezbyt mocną zasadą Brønsteda, która reaguje z cząsteczką wody zgodnie z równaniem:
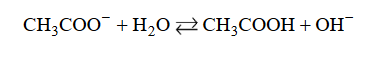
Równowagę tej reakcji opisuje stała dysocjacji zasadowej Kb, wyrażona następującym
równaniem:
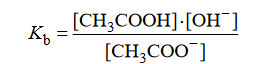
Iloczyn stałej dysocjacji kwasowej Ka kwasu CH₃COOH i stałej dysocjacji zasadowej Kb sprzężonej z nim zasady CH3COO⁻ jest równy iloczynowi jonowemu wody: Ka∙Kb = Kw. W temperaturze 25ºC iloczyn jonowy wody jest równy Kw = 1, 0 * 10⁻¹⁴.
Oblicz pH wodnego roztworu octanu sodu o stężeniu 0,05 mol*dm⁻³ w temperaturze 25 ºC. Przyjmij, że reakcji z wodą ulega mniej niż 5% anionów octanowych
Stopnie utlenienia azotu w cząsteczkach i jonach
Arkusz maturalny z chemii podstawowej maj 2005
Określ stopnie utlenienia azotu w podanych w tabeli cząsteczkach i jonie:

Równania procesu redukcji i procesu utleniania. Siarczan (VI) manganu (II), siarczan (IV) potasu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
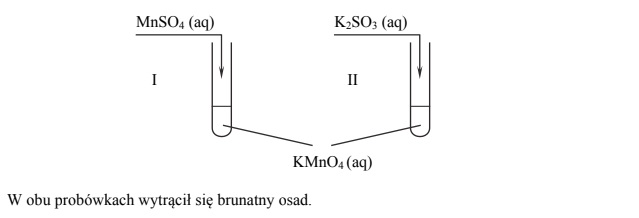
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu po reakcji w probówce I:
Nazwa anionu zawierającego siarkę:
Podczas elektrolizy wodnego roztworu chlorku chromu(III) CrCl3…
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Podczas elektrolizy wodnego roztworu chlorku chromu(III) CrCl3 (prowadzonej przy użyciu
elektrod grafitowych) przez roztwór przepłynął ładunek elektryczny Q, co skutkowało
wydzieleniem 156 gramów chromu.
Oblicz, ile gramów cynku wydzieli się podczas przepływu takiego samego ładunku Q przez
roztwór chlorku cynku ZnCl2. Przyjmij, że opisane procesy zachodzą ze 100%
wydajnością. Stała Faradaya ma wartość F = 96500 C mol .

Efekty energetyczny reakcji tlenku węgla(IV) z węglem
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
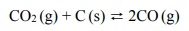
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
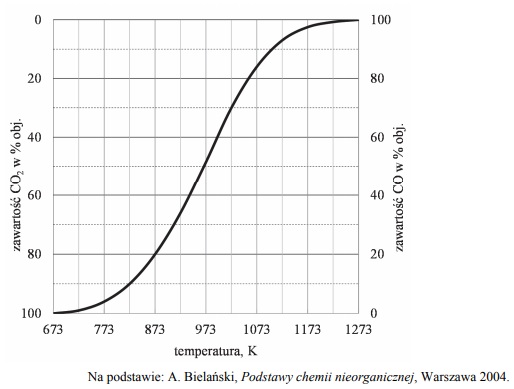
Oceń, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem endo- czy egzoenergetycznym. Odpowiedź uzasadnij.
Dwa gazy a i b zmieszane w stosunku molowym…
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Dwa gazy A i B zmieszane w stosunku molowym AB: 1:4 nn = zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
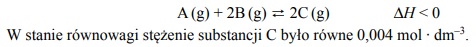
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Wskazówki
- Warunki izobaryczne to warunki w których ciśnienie układu nie ulega zmianie.
- Warunki izotermiczne to warunki w których temperatura układu nie ulega zmianie
- Reguła przekory:
Jeśli na układ znajdujący się w stanie równowagi podziała bodziec zewnętrzny, to w układzie tym zajdą przemiany prowadzące do zminimalizowania działania bodźca.
Wyjaśnienie szczegółowe można znaleźć także tutaj – link do naukowiec.org