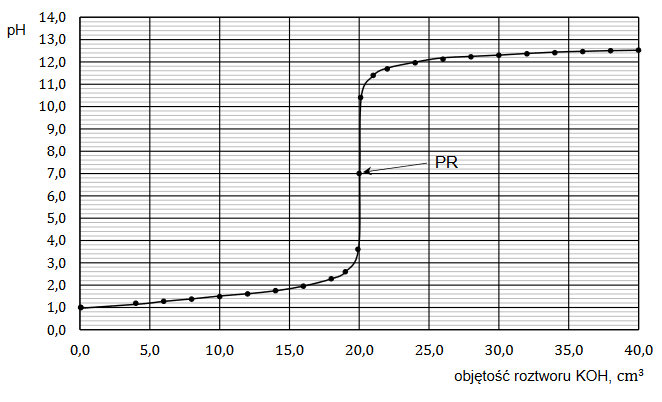
Reakcja hydratacji
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:

Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
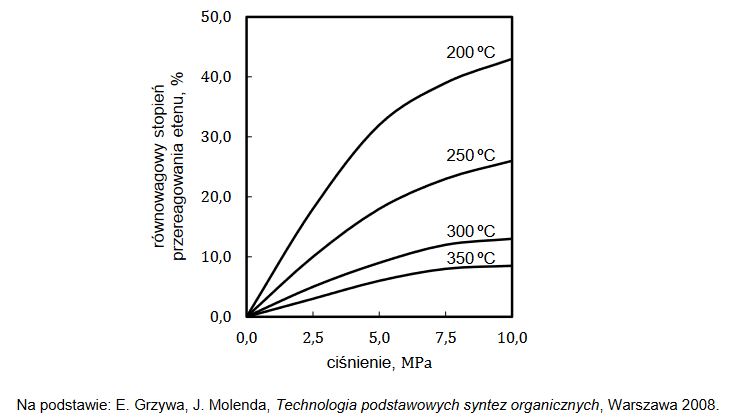
1. Wyjaśnij, dlaczego w danej temperaturze równowagowy stopień przereagowania etenu w opisanej reakcji jest tym większy, im wyższe jest ciśnienie, pod którym prowadzona jest reakcja.
2. Rozstrzygnij, czy reakcja hydratacji etenu jest procesem endo– czy egzotermicznym. dpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
stężeniowa stała równowagi reakcji rozkładu i syntezy
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Reakcja rozkładu chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
2BrCl (g) ⇄ Br2 (g) + Cl2 (g)
Wartość stężeniowej stałej równowagi reakcji rozkładu chlorku bromu(I) w temperaturze 500 K jest równa 32.
Na podstawie: L. Jones, P. Atkins, Chemia ogólna, Warszawa 2009.
Reakcja syntezy chlorku bromu(I) przebiega w fazie gazowej zgodnie z równaniem:
Br2 (g) + Cl2 (g) ⇄ 2BrCl (g)
Oblicz wartość stężeniowej stałej równowagi reakcji syntezy chlorku bromu(I) w temperaturze 𝟓𝟎𝟎 𝐊.
proces dysocjacji
Arkusz z chemii rozszerzonej maj 2023 stara formuła
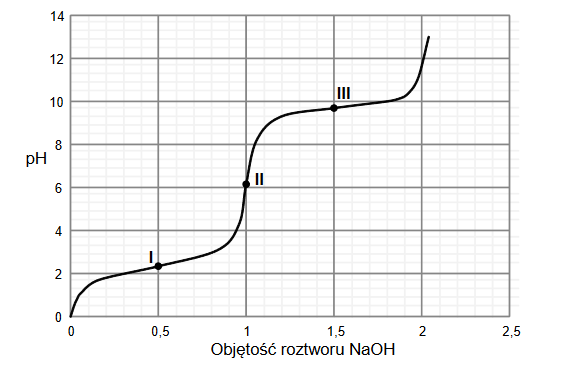
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze.
Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (α) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20°C.
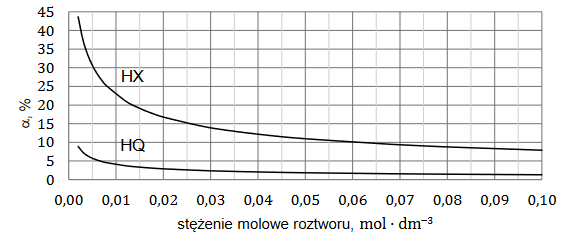
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij.
HX HQ
Uzasadnienie:
pary kwas – zasada Brønsteda
Arkusz z chemii rozszerzonej maj 2023 stara formuła
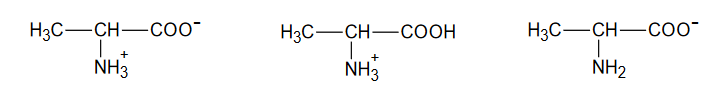
Spośród wymienionych par drobin wybierz i zaznacz wszystkie te, które nie tworzą sprzężonej pary Brønsteda kwas – zasada.
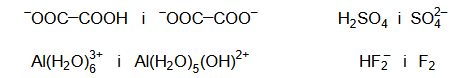
definicja kwasu i zasady Brønsteda
Arkusz z chemii rozszerzonej maj 2023 stara formuła
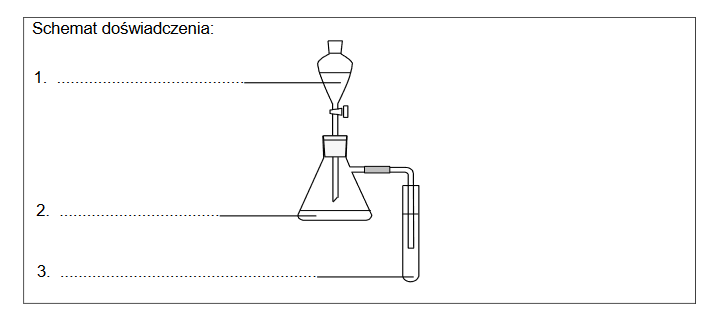
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
• do probówki 1. – kilka kropel roztworu fenoloftaleiny
• do probówki 2. – nadmiar stężonego HCl (aq).
1. Zawartość probówki 1., po dodaniu do niej roztworu fenoloftaleiny, zabarwiła się na kolor czerwonoróżowy (malinowy).
Wpisz do schematu wzory odpowiednich drobin tak, aby powstało równanie procesu decydującego o odczynie roztworu w probówce 1. Zastosuj definicję kwasu i zasady
Brønsteda.
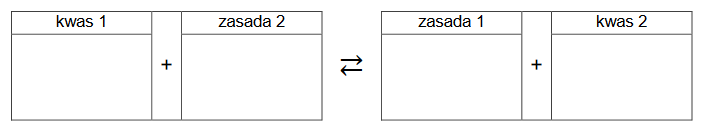
2. Napisz, co zaobserwowano podczas doświadczenia w probówce 2. po dodaniu odczynnika. Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną zaobserwowanych zmian.
Obserwacje:
Równanie reakcji:
rozpuszczalność amoniaku w wodzie
Arkusz z chemii rozszerzonej maj 2023 stara formuła
W temperaturze 25 °C rozpuszczalność amoniaku w wodzie jest równa 46 g w 100 g wody.
Na podstawie: K. H. Lautenschläger i in., Nowoczesne kompendium chemii, Warszawa 2007.
Oblicz pH wodnego roztworu amoniaku nasyconego w tej temperaturze, jeżeli jego gęstość jest równa 𝟎, 𝟗𝟏 𝐠 ∙ 𝐜𝐦–𝟑. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie odczynu roztworów
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Wymieszano po dwa wodne roztwory różnych soli o stężeniu ok. 0,5 mol ∙ dm−3. W ten sposób otrzymano roztwory A i B, których skład podany jest w poniższej tabeli.
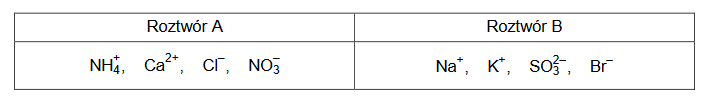
Określ odczyn roztworów A i B.
Odczyn roztworu A:
Odczyn roztworu B:
określanie odczynu różnych roztworów
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Przygotowano wodne roztwory następujących substancji:
1. kwasu azotowego(V) o stężeniu 0,5 mol ∙ dm−3
2. kwasu octowego (etanowego) o stężeniu 0,5 mol ∙ dm−3
3. wodorotlenku baru o pH = 11
4. wodorotlenku potasu o pH = 11.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wartość pH roztworu kwasu azotowego(V) jest (większa niż / mniejsza niż / taka sama jak) wartość pH roztworu kwasu octowego.
Spośród roztworów o odczynie zasadowym mniejsze stężenie molowe ma roztwór numer (3 / 4).
zależność rozpuszczalności amoniaku w wodzie od temperatury
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Dane w poniższej tabeli pokazują zależność rozpuszczalności amoniaku w wodzie od temperatury.

Narysuj krzywą rozpuszczalności amoniaku w wodzie w zakresie temperatury od 20 °C do 80 °C i odczytaj – w zaokrągleniu do jedności – wartość rozpuszczalności tego gazu w temperaturze 68 °C. Rozpuszczalność amoniaku w wodzie w podanym zakresie temperatury jest funkcją malejącą.
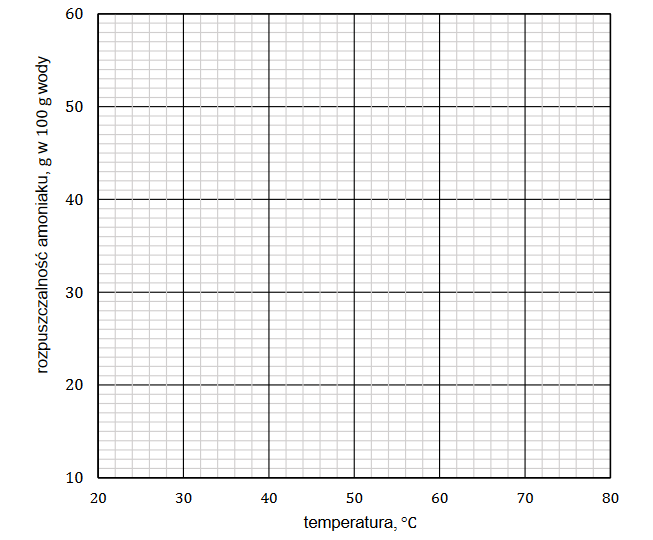
Rozpuszczalność amoniaku w temperaturze 68 °C: …. g w 100 g wody.
rozpuszczalne hydraty Chlorku wapnia
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Chlorek wapnia tworzy rozpuszczalne hydraty o wzorze ogólnym CaCl2 ∙ 𝑛H2O. W zależności od temperatury w równowadze z roztworem nasyconym pozostają hydraty o różnych wartościach współczynnika 𝑛. W temperaturze 40 °C jeden z hydratów chlorku wapnia rozpuszcza się w ilości 767,4 g na 100 g wody, a stężenie nasyconego roztworu chlorku wapnia wynosi 53,66 % masowych.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wykonaj obliczenia i napisz wzór opisanego hydratu chlorku wapnia.
Obliczenia:
Wzór hydratu:
Technet
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Technet, podobnie jak mangan, jest pierwiastkiem, który w związkach chemicznych może występować na VI stopniu utlenienia. Jony TcO42− są trwałe jedynie w środowisku silnie zasadowym, natomiast w roztworach obojętnych ulegają dysproporcjonowaniu, zgodnie ze schematem:
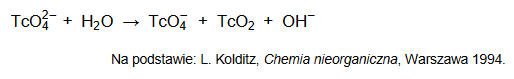
Napisz w formie jonowej skróconej, z uwzględnieniem liczby wymienianych elektronów (zapis jonowo–elektronowy), równanie reakcji redukcji zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji.
identyfikacja substancji chemicznych
Arkusz z chemii rozszerzonej maj 2023 stara formuła
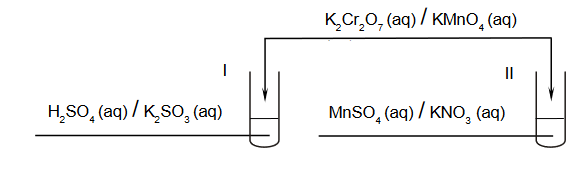
Przeprowadzono doświadczenie, podczas którego do probówek I i II z wodnymi roztworami pewnych substancji dodano jeden, taki sam odczynnik. W obu probówkach zaszły reakcje utleniania i redukcji. Po zakończeniu doświadczenia w obu probówkach widoczny był brunatny osad.
Uzupełnij schemat przeprowadzonego doświadczenia. Zaznacz wzory substancji, których wodne roztwory znajdowały się w probówkach I i II, oraz wzór odczynnika dodanego do obu probówek.