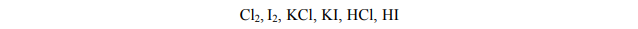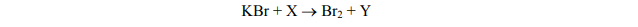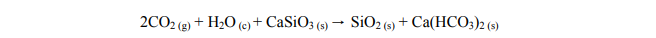Konfiguracja elektronów walencyjnych pierwiastka.
Arkusz maturalny z chemii podstawowej maj 2010
Atomy pewnego pierwiastka w stanie podstawowym mają następującą konfigurację elektronów walencyjnych:

Określ położenie tego pierwiastka w układzie okresowym, wpisując poniżej numer grupy oraz numer okresu.
Numer grupy:
Numer okresu:
Ustalanie liczby atomowej i masowej.
Arkusz maturalny z chemii podstawowej maj 2010
W jądrze pierwiastka X znajduje się tyle protonów, ile neutronów zawiera jądro
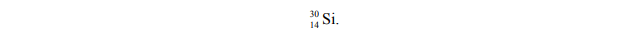
Liczba masowa jednego z izotopów pierwiastka X jest równa liczbie elektronów w atomie
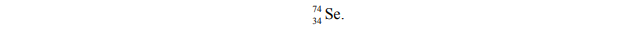
Korzystając z powyższej informacji, ustal liczbę atomową pierwiastka X oraz liczbę masową opisanego izotopu pierwiastka X.

Przemiana alfa, ustalanie wzoru pierwiastka.
Arkusz maturalny z chemii podstawowej maj 2010
Promieniotwórczy izotop pierwiastka Z uległ przemianie α i przekształcił się w izotop
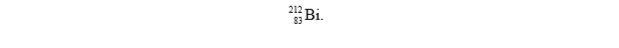
Korzystając z układu okresowego, ustal symbol pierwiastka Z.
Symbol pierwiastka Z:
Obliczanie liczby atomów żelaza w białku.
Arkusz maturalny z chemii podstawowej maj 2010
Hemoglobina, złożone białko krwinek czerwonych (erytrocytów) o masie cząsteczkowej 70200 u, zawiera 0,3191% masowych żelaza.
Oblicz liczbę atomów żelaza znajdujących się w jednej cząsteczce tego białka. W obliczeniach przyjmij przybliżoną wartość masy atomowej żelaza MFe = 56 u

Stopnie utlenienia tlenu i sodu.
Arkusz maturalny z chemii podstawowej maj 2010
Lit i sód to aktywne metale, które w związkach chemicznych przyjmują stopień utlenienia I.
Reakcje litu i sodu z chlorem i siarką przebiegają podobnie – ich produktami są odpowiednie
chlorki oraz siarczki. Reakcją, która odróżnia lit od sodu, jest utlenianie obu metali
w strumieniu tlenu. Lit tworzy w tych warunkach tlenek o wzorze Li2O, a sód – nadtlenek
o wzorze Na2O2. Oba metale reagują z wodą, przy czym reakcja sodu z wodą przebiega
gwałtowniej niż reakcja litu z wodą.
Napisz, jakie stopnie utlenienia przyjmują sód i tlen w nadtlenku sodu (Na2O2).
Stopień utlenienia sodu:
Stopień utlenienia tlenu:
Otrzymywanie siarczku sodu.
Arkusz maturalny z chemii podstawowej maj 2010
Lit i sód to aktywne metale, które w związkach chemicznych przyjmują stopień utlenienia I.
Reakcje litu i sodu z chlorem i siarką przebiegają podobnie – ich produktami są odpowiednie
chlorki oraz siarczki. Reakcją, która odróżnia lit od sodu, jest utlenianie obu metali
w strumieniu tlenu. Lit tworzy w tych warunkach tlenek o wzorze Li2O, a sód – nadtlenek
o wzorze Na2O2. Oba metale reagują z wodą, przy czym reakcja sodu z wodą przebiega
gwałtowniej niż reakcja litu z wodą.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania siarczku sodu z pierwiastków.
Reaktywność sodu i litu.
Arkusz maturalny z chemii podstawowej maj 2010
Lit i sód to aktywne metale, które w związkach chemicznych przyjmują stopień utlenienia I.
Reakcje litu i sodu z chlorem i siarką przebiegają podobnie – ich produktami są odpowiednie
chlorki oraz siarczki. Reakcją, która odróżnia lit od sodu, jest utlenianie obu metali
w strumieniu tlenu. Lit tworzy w tych warunkach tlenek o wzorze Li2O, a sód – nadtlenek
o wzorze Na2O2. Oba metale reagują z wodą, przy czym reakcja sodu z wodą przebiega
gwałtowniej niż reakcja litu z wodą.
Ustal, który z metali (lit czy sód) jest mniej reaktywny, i napisz w formie cząsteczkowej równanie reakcji tego metalu z wodą.