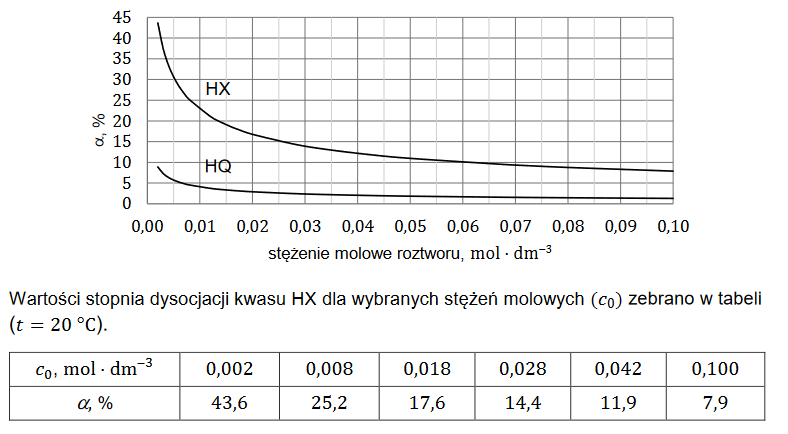
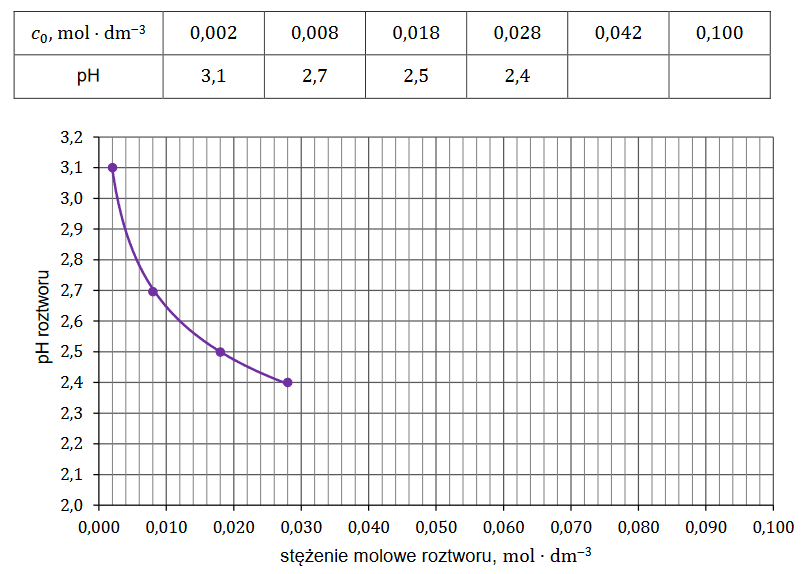
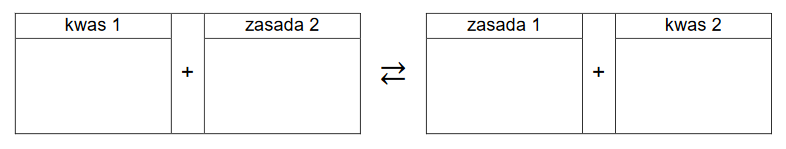
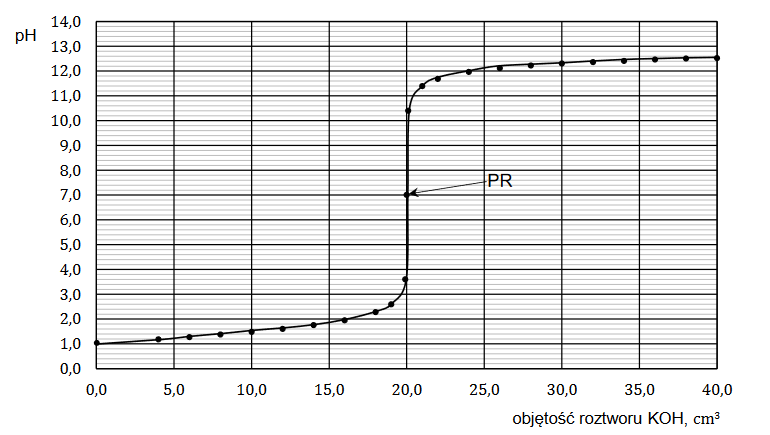
superciężkie jądra pierwiastków
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
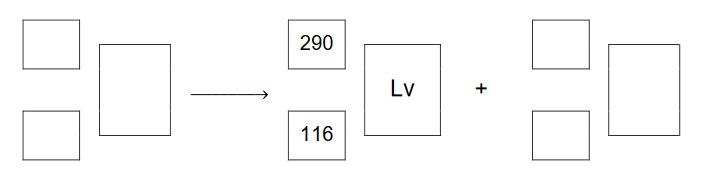
Aby otrzymać superciężkie jądra pierwiastków z końca 7. okresu, kaliforn Cf ⁹⁸ ₂₄₉ bombardowano jonami izotopu wapnia Ca²⁰ ₄₈. Podczas jednego z eksperymentów zarejestrowano przemianę:
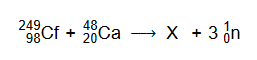
Napisz równanie reakcji rozpadu, której uległo jądro pierwiastka X. Uzupełnij wszystkie pola w poniższym schemacie.
odmiany alotropowe węgla
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

szybkość reakcji chemicznej
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Pewna reakcja chemiczna:

Oblicz szybkość opisanej reakcji w momencie, w którym przereagowało 𝟓𝟎 % początkowej ilości substancji B.
analiza mieszany dwóch soli
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
W celu określenia zawartości węglanu wapnia w mieszaninie dwóch soli, zawierającej również węglan magnezu, próbkę tej mieszaniny o masie 2,84 g roztworzono w kwasie. Podczas analizy przebiegły reakcje chemiczne:
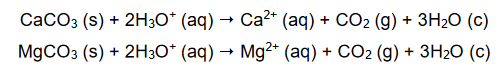
W wyniku zachodzących reakcji otrzymano 672 cm3 tlenku węgla(IV) w przeliczeniu na warunki normalne.
Oblicz wyrażoną w procentach masowych zawartość CaCO3 w badanej próbce mieszaniny.
hydrat chlorku wapnia
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Chlorek wapnia tworzy rozpuszczalne hydraty o wzorze ogólnym CaCl2 ∙ 𝑛H2O. W zależności od temperatury w równowadze z roztworem nasyconym pozostają hydraty o różnych wartościach współczynnika 𝑛.
W temperaturze 40 °C jeden z hydratów chlorku wapnia rozpuszcza się w ilości 767,4 g na 100 g wody, a stężenie nasyconego roztworu chlorku wapnia wynosi 53,66 % masowych.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wykonaj obliczenia i napisz wzór opisanego hydratu chlorku wapnia.
aniony tiosiarczanowe W środowisku wodnym
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
W środowisku wodnym aniony tiosiarczanowe reagują z chlorem zgodnie ze schematem:
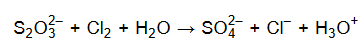
Podczas tej reakcji aniony tiosiarczanowe ulegają utlenieniu, które przebiega według schematu:
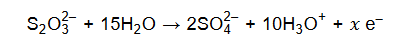
Uzupełnij współczynniki stechiometryczne w poniższym schemacie reakcji.
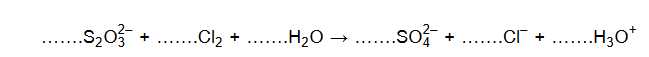
Technet
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Technet, podobnie jak mangan, jest pierwiastkiem, który w związkach chemicznych może występować na VI stopniu utlenienia. Jony TcO42− są trwałe jedynie w środowisku silnie zasadowym, natomiast w roztworach obojętnych ulegają dysproporcjonowaniu, zgodnie ze schematem:
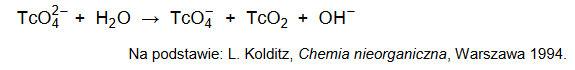
Napisz w formie jonowej skróconej, z uwzględnieniem liczby wymienianych elektronów (zapis jonowo–elektronowy), równanie reakcji redukcji zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji.