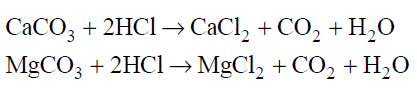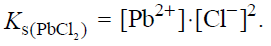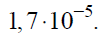Obliczanie masy molowej substancji.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Masowy stosunek stechiometryczny substratów reakcji
2A + B → C + 3D
wynosi mA : mB = 4 : 7. W reakcji zużyto 45 g substancji B i stechiometryczną ilość substancji A. W wyniku reakcji, przebiegającej z wydajnością równą 100%, otrzymano 13 dm3 gazowego produktu C (objętość zmierzono w warunkach normalnych). Masa molowa substancji C jest równa 26 g·mol−1.
Oblicz masę molową substancji D.
Otrzymywanie gazowego chlorowodoru.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI) na stałe chlorki, np. w reakcjach opisanych równaniami:
2NaCl + H2SO4 → Na2SO4 + 2HCl
CaCl2 + H2SO4 → CaSO4 + 2HCl
Sporządzono 150 g mieszaniny zawierającej tylko NaCl i CaCl2, na którą podziałano stężonym kwasem siarkowym(VI) użytym w nadmiarze. W wyniku tego procesu otrzymano 58,24 dm3 chlorowodoru (w warunkach normalnych).
Oblicz skład wyjściowej mieszaniny w procentach masowych. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Oblicz, ile centymetrów sześciennych wodnego roztworu kwasu etanowego o stężeniu równym 41,0%
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Oblicz, ile centymetrów sześciennych wodnego roztworu kwasu etanowego o stężeniu równym 41,0% masowych i gęstości 1,05 g·cm−3 należy rozcieńczyć wodą, aby otrzymać 200,00 cm3 roztworu kwasu etanowego o stężeniu 0,70 mol·dm−3.
Wydajność przemiany chlorku sodu z kwasem siarkowym(VI)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Próbkę stałego chlorku sodu o masie 7,5 g poddano działaniu stężonego kwasu siarkowego(VI). Zaszła wówczas reakcja opisana równaniem:
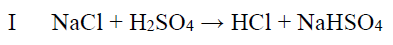
Tę reakcję prowadzono aż do całkowitego zużycia chlorku sodu. Otrzymany w tej reakcji chlorowodór zebrano, rozpuszczono w wodzie i poddano działaniu tlenku manganu(IV),
w wyniku czego zaszła reakcja zgodnie z równaniem:
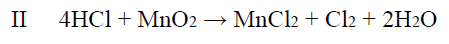
Powstały w tej przemianie chlor wprowadzono do wodnego roztworu jodku potasu i otrzymano 6,35 grama jodu zgodnie z równaniem:
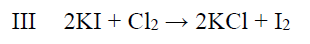
Oblicz wydajność przemiany II, jeżeli przemiany I i III zaszły z wydajnością równą 100%.
Stała stężeniowa reakcji wody z tlenkiem węgla(IV)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Stężeniowa stała równowagi reakcji
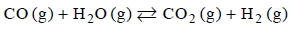
w temperaturze 1000 K jest równa 1.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W reaktorze o stałej pojemności znajdowało się 6 moli tlenku węgla(II).
Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora, aby po ustaleniu się równowagi w temperaturze 1000 K liczba moli wodoru była dwa razy większa od liczby moli tlenku węgla(II).
Zmieszano w zbiorniku metan z tlenem.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W zbiorniku o stałej pojemności znajdowały się w pewnych warunkach ciśnienia i temperatury innych niż warunki normalne 2 mole metanu i 2 mole tlenu. Po zainicjowaniu reakcji przebiegła ona zgodnie z równaniem:
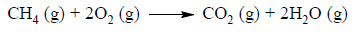
Napisz, w jakim stosunku objętościowym i masowym zmieszano w zbiorniku metan z tlenem. Określ stosunek objętościowy tlenku węgla(IV) i pary wodnej w zbiorniku po zakończeniu reakcji. Stosunek objętościowy i masowy wyraź za pomocą najmniejszych liczb całkowitych.
Stosunek objętościowy V metanu : V tlenu =
Stosunek masowy m metanu : m tlenu =
Stosunek objętościowy V tlenku węgla(IV) : V pary wodnej =
Uporządkowanie gazów pod względem objętości.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przygotowano próbki następujących gazów: NO2, CH4, NH3, SO2 i O2 o jednakowej masie. Wszystkie gazy znajdują się w tych samych warunkach ciśnienia i temperatury. Przyjmij, że w opisanych warunkach NO2 nie ulega dimeryzacji.
Spośród podanych gazów wybierz i zapisz wzory tych, które po wprowadzeniu do probówek z wodnym roztworem oranżu metylowego spowodują zmianę barwy zawartości probówek.
Uporządkuj próbki gazów zgodnie z ich rosnącą objętością. Napisz wzory gazów w odpowiedniej kolejności.
……………………………………………………………………………………………………
najmniejsza objętość największa objętość
Węglan litu i chlorek sodu – rozpuszczalność
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Wykres rozpuszczalności w wodzie dwóch soli: węglanu litu i chlorku ołowiu(II), w zależności od temperatury przedstawia poniższy wykres.
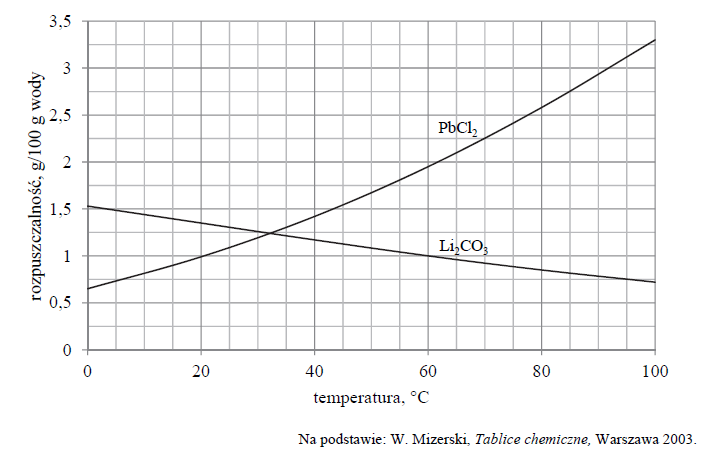
W dwóch zlewkach A i B zmieszano z wodą – odpowiednio – węglan litu oraz chlorek ołowiu(II) i otrzymano mieszaniny o temperaturze 60 ºC. Przebieg doświadczenia zilustrowano na poniższym schemacie.
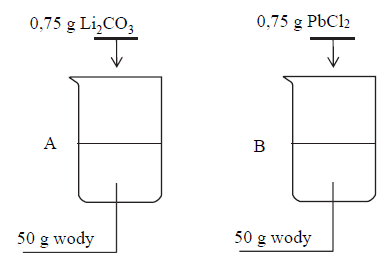
Napisz oznaczenie zlewki, w której powstał roztwór nienasycony, oraz napisz najwyższą wartość temperatury, poniżej której otrzymano by w tej zlewce roztwór nasycony w równowadze z osadem.
Roztwór nienasycony powstał w zlewce
Otrzymano by roztwór nasycony w temperaturze niższej niż
Obliczanie nierozpuszczonej soli węglanu litu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Wykres rozpuszczalności w wodzie dwóch soli: węglanu litu i chlorku ołowiu(II), w zależności od temperatury przedstawia poniższy wykres.

W dwóch zlewkach A i B zmieszano z wodą – odpowiednio – węglan litu oraz chlorek
ołowiu(II) i otrzymano mieszaniny o temperaturze 60 ºC. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Do zlewki A dolano 20,00 g roztworu Li2CO3 o stężeniu 1% (w procentach masowych) i zawartość zlewki oziębiono do temperatury 30 °C.
Oblicz masę węglanu litu, który pozostanie nierozpuszczony. Wynik podaj w gramach w zaokrągleniu do drugiego miejsca po przecinku.
Mieszanina gazów: tlenku węgla(IV), amoniaku oraz metanu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Mieszaninę gazów składającą się z tlenku węgla(IV), amoniaku i metanu o objętości 9,78 dm3 przepuszczono w temperaturze 25 °C i pod ciśnieniem 1013 hPa przez płuczki, których zawartość przedstawia poniższy rysunek. Stosunek molowy amoniaku do metanu w wyjściowej mieszaninie był równy 3 : 1. Po przepuszczeniu mieszaniny gazów przez płuczki okazało się, że tylko jeden gaz nie został pochłonięty i opuścił zestaw płuczek.
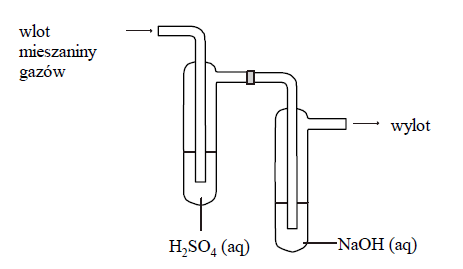
Podczas przepuszczenia gazów przez płuczki, w płuczce z wodnym roztworem wodorotlenku sodu zachodziła reakcja:
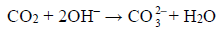
Masa tej płuczki wzrosła o 5,28 g.
Oblicz, jaką objętość zająłby w warunkach normalnych amoniak, który był składnikiem mieszaniny. Uniwersalna stała gazowa R = 83,1 dm3·hPa·mol–1·K–1.
Płytka kadmowa w roztworze soli miedzi.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W wodnym roztworze Cu(NO3)2 zanurzono płytkę kadmową o masie 75,0 g. Po pewnym czasie wyjęto ją, osuszono i zważono. Jej masa wynosiła 73,0 g. Stwierdzono, że w warunkach doświadczenia cały wydzielony metal osadził się na płytce.
Dokończ poniższe zdanie – wybierz i podkreśl właściwy opis spostrzeżenia spośród podanych w nawiasie.
Po zanurzeniu płytki kadmowej do wodnego roztworu Cu(NO3)2 zaobserwowano po dłuższym czasie, że barwa roztworu zmieniła się z (fioletowej na niebieską / bezbarwnej na zieloną / niebieskiej na bezbarwną).
Oblicz, ile gramów każdego z metali zawierała płytka po wyjęciu jej z roztworu. Przyjmij, że proces osadzania metalu na płytce zachodził z wydajnością równą 100%.
Ubichinon jako niezbędny element łańcucha oddechowego.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Ubichinon Q10 (koenzym Q10) jest niezbędnym elementem łańcucha oddechowego. Zapobiega produkcji rodników, oksydacyjnym modyfikacjom białek, lipidów oraz DNA i pełni szereg innych funkcji w organizmie. Poniżej przedstawiono wzór opisujący strukturę cząsteczki ubichinonu Q10.
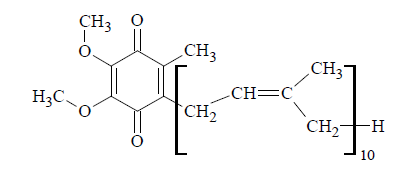
Przeprowadzono analizę elementarną pewnej substancji biologicznie czynnej i stwierdzono, że zawiera ona 82,13% masowych węgla i 10,44% masowych wodoru.
Wykonaj obliczenia i oceń, czy badanym związkiem mógł być ubichinon Q10 o wzorze sumarycznym C59H90O4. W obliczeniach przyjmij, że MC = 12,00 g · mol–1, MH = 1,00 g · mol–1, MO = 16,00 g · mol–1.