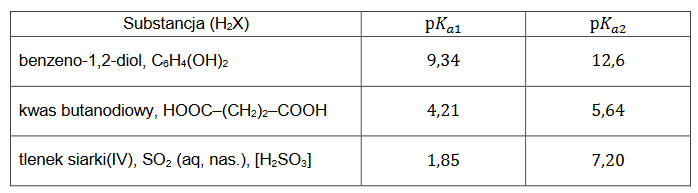
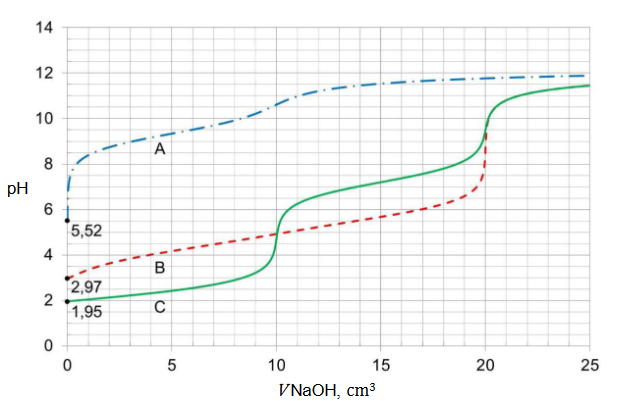
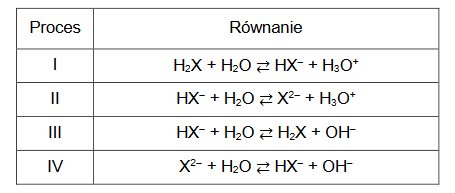
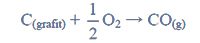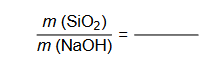procentowa masowa zawartość substancji w mieszaninie wyjściowej
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
W celu określenia zawartości tlenku kobaltu(II) w mieszaninie zawierającej tylko CoO i Co3O4 próbkę tej mieszaniny o masie 100 g poddano prażeniu. Podczas tego procesu zaszły reakcje chemiczne:
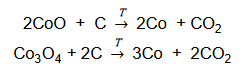
W wyniku zachodzących reakcji otrzymano 75,0 g metalicznego kobaltu.
Oblicz w procentach masowych zawartość tlenku kobaltu(II) w wyjściowej mieszaninie. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100 %.
rozpuszczalność pewnego hydratu
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 𝟐𝟎 °𝐂 rozpuszczalność hydratu wynosi 𝟏𝟕𝟔 𝐠 w 𝟏𝟎𝟎 𝐠 wody.
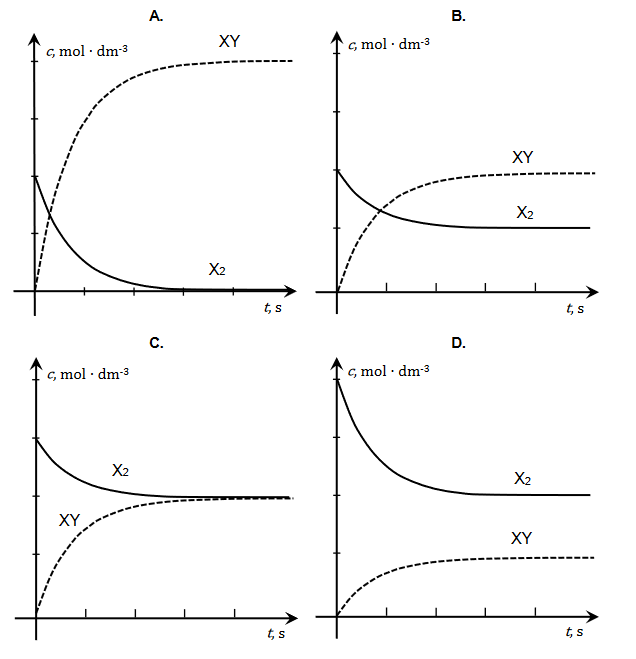
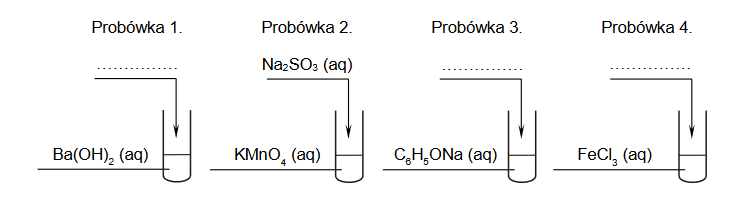
Bezbarwny wodny roztwór pewnych dwóch soli
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Bezbarwny wodny roztwór dwóch soli może zawierać znaczące ilości następujących jonów:
Br– S2– SO42– NH4+ Mg2+
W celu ustalenia składu badanego roztworu pobrano cztery jego próbki i wykonano doświadczenia zilustrowane na poniższym schemacie:
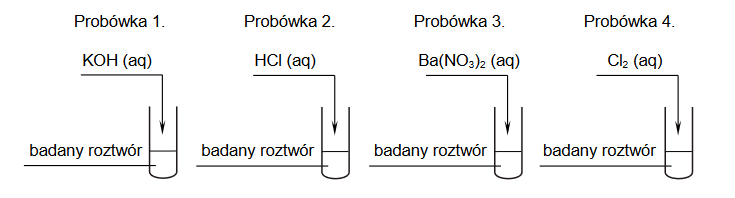
Wszystkie wyniki doświadczenia przedstawiono w tabeli.

1. Napisz wzory sumaryczne dwóch soli, z których przygotowano badany roztwór.
2. Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczenia w probówkach 1. i 4.
Równanie reakcji zachodzącej w probówce 1.:
Równanie reakcji zachodzącej w probówce 4.:
Mieszanie roztworów o różnych stężeniach
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Zmieszano 500 cm3 wodnego roztworu wodorotlenku sodu o nieznanym stężeniu 𝑐 (roztwór A) i 250 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,10 mol * dm^3 (roztwór B). W temperaturze 25°C pH otrzymanego roztworu C wynosiło 12,7.
Oblicz stężenie molowe 𝒄 roztworu A wodorotlenku sodu. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów. Wynik podaj z odpowiednią jednostką.
otrzymywanie wodorotlenku glinu
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Uczniowie przeprowadzili dwuetapowe doświadczenie, w którym w temperaturze pokojowej otrzymali z metalicznego glinu wodorotlenek glinu.
1. Wybierz i zaznacz na poniższym schemacie wzory odczynników, których użyto podczas doświadczenia przeprowadzonego przez uczniów.
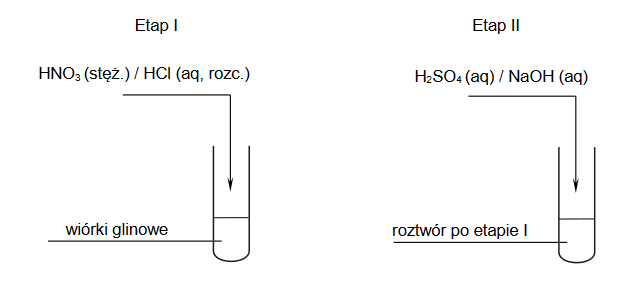
2. Zapisz w formie jonowej skróconej:
• równanie reakcji zachodzącej w etapie I
• równanie reakcji zachodzącej w etapie II
opisanego doświadczenia, a następnie napisz, jakie zmiany zaobserwowano po dodaniu – w etapie II – nadmiaru wybranego odczynnika.
Równania reakcji:
Etap I:
Etap II:
Zaobserwowane zmiany:
Obliczenia w roztworach wodnych
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 𝟐𝟎 °𝐂 rozpuszczalność hydratu wynosi 𝟏𝟕𝟔 𝐠 w 𝟏𝟎𝟎 𝐠 wody.