Właściwości roztworu chlorku żelaza(III).
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Oceń, czy podane poniżej informacje dotyczące chlorku żelaza(III) są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, lub F – jeśli jest fałszywa.

Otrzymywanie wodnych roztworów soli.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
W temperaturze T stała dysocjacji kwasowej kwasu etanowego (octowego) jest równa Ka = 1,8 · 10–5, a stała dysocjacji zasadowej amoniaku jest równa Kb = 1,8 · 10–5.
Przeprowadzono doświadczenie, w którym po zmieszaniu reagentów w stosunku stechiometrycznym powstały wodne roztwory soli o temperaturze T. Odczyn roztworu wodnego otrzymanej soli:
• w probówce I był zasadowy;
• w probówce II – kwasowy;
• w probówce III – obojętny.
Uzupełnij schemat przeprowadzonego doświadczenia. Wpisz wzory użytych odczynników wybranych spośród:
NH3 (aq)
CO2 (g)
K (s)
HCl(aq)
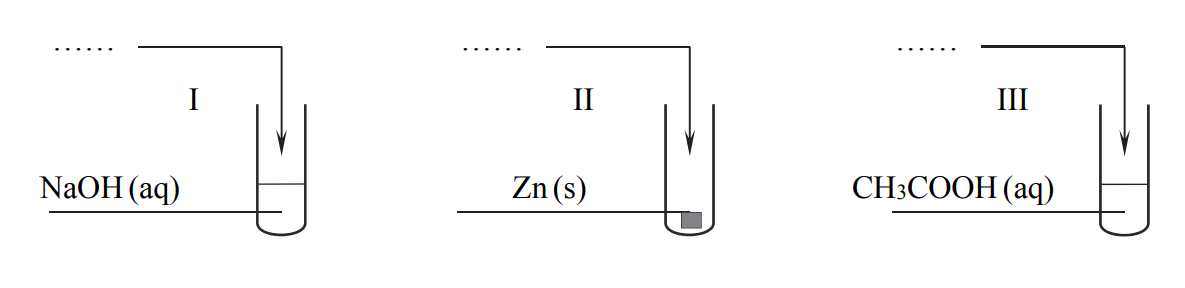
Napisz w formie jonowej skróconej równanie reakcji otrzymywania tej soli, której wodny roztwór powstał w probówce I.
…………………………………………………………………………………………………..
Standardowa entalpia metanalu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
W tabeli podano wartości standardowej entalpii spalania metanu, wodoru i węgla.

Oblicz standardową entalpię tworzenia metanu. Oceń, czy poprawne jest twierdzenie, że w reakcji syntezy metanu z pierwiastków produkt ma energię wyższą od substratów. Uzasadnij swoją ocenę.
Reakcja dysproporcjonowania kwasu fosfonowego.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Podczas ogrzewania kwas fosfonowy H3PO3 (H2PHO3) ulega reakcji dysproporcjonowania, w wyniku której powstają kwas ortofosforowy(V) i fosforowodór.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie cząsteczkowej równanie opisanej reakcji.
Reakcje siarczanu (IV) sodu i krzemianu sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.

Napisz, co można zaobserwować w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian.
Równanie reakcji przebiegającej w probówce I:
Równanie reakcji przebiegającej w probówce II:
Otrzymywanie gazowego chlorowodoru.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI) na stałe chlorki, np. w reakcjach opisanych równaniami:
2NaCl + H2SO4 → Na2SO4 + 2HCl
CaCl2 + H2SO4 → CaSO4 + 2HCl
Sporządzono 150 g mieszaniny zawierającej tylko NaCl i CaCl2, na którą podziałano stężonym kwasem siarkowym(VI) użytym w nadmiarze. W wyniku tego procesu otrzymano 58,24 dm3 chlorowodoru (w warunkach normalnych).
Oblicz skład wyjściowej mieszaniny w procentach masowych. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Kwasy i zasady w teorii Brønsteda–Lowry’ego
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Dany jest zbiór drobin:
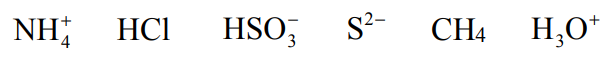
Spośród podanych drobin wybierz wszystkie, które według teorii Brønsteda–Lowry’ego mogą w roztworze wodnym pełnić funkcję zasady. Napisz odpowiednie wzory. Dla jednej z wybranych drobin napisz równanie reakcji z wodą, w której to reakcji wybrana drobina pełni funkcję zasady.
Wzory drobin, które mogą pełnić funkcję zasady:
Równanie reakcji wybranej drobiny z wodą:
pH fenolu, kwasu solnego, metyloaminy i alkoholu etylowego.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła

Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów – zapisz wzory tych związków w odpowiedniej kolejności. Napisz w formie jonowej równanie reakcji, która uzasadnia odczyn roztworu o najwyższym pH.
Kolejność związków zgodnie z rosnącym pH roztworów:
Równanie reakcji, która uzasadnia odczyn roztworu o najwyższym pH:
Iloczyn rozpuszczalności chlorku srebra.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
W temperaturze 25 °C iloczyn rozpuszczalności chlorku srebra w wodzie jest równy 1,8·10−10.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002.
Do wodnego roztworu azotanu(V) srebra dodano wodny roztwór chlorku potasu i otrzymano mieszaninę o objętości 1 dm3
i o temperaturze 25 °C. W tej mieszaninie stężenie azotanu(V) srebra wynosiło 1,0·10−4 mol·dm−3, a stężenie chlorku potasu było równe 1,0·10−6 mol·dm−3.
Czy po zmieszaniu roztworów wytrącił się osad chlorku srebra? Odpowiedź uzasadnij.
Przesuwanie stanu równowagi. Osad chlorku sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Do dwóch zlewek zawierających po 100 cm3 wody destylowanej o temperaturze 25 °C wprowadzono po 5 g chlorku srebra. Po pewnym czasie w zlewkach powstały nasycone roztwory chlorku srebra i ustalił się stan równowagi między osadem a roztworem. Następnie do pierwszej zlewki dodano 1 g stałego chlorku potasu, a do drugiej dolano 20 cm3 wody o temperaturze 25 °C.
Opisany eksperyment przedstawiono na poniższym rysunku:
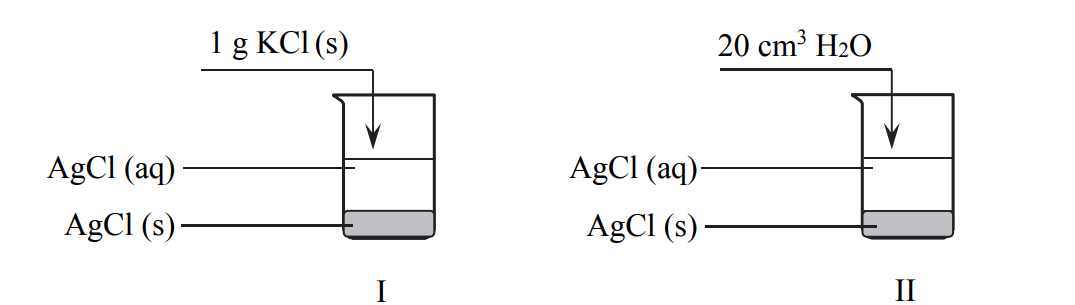
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Po dodaniu chlorku potasu i po ponownym ustaleniu się stanu równowagi masa osadu
w zlewce I była (większa niż / taka sama jak / mniejsza niż) przed dodaniem soli.
Po dodaniu wody do zlewki II i po ponownym ustaleniu się stanu równowagi stężenie jonów srebra było (większe niż / takie samo jak / mniejsze niż) przed dodaniem wody.
Redukcja jodanów za pomocą wodorosiarczanu (IV) sodu
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa 1994
Jedną z opisanych reakcji przedstawia poniższy schemat.
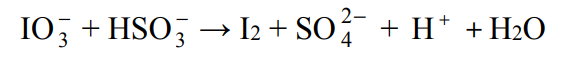
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie procesu redukcji:
Równanie procesu utleniania:
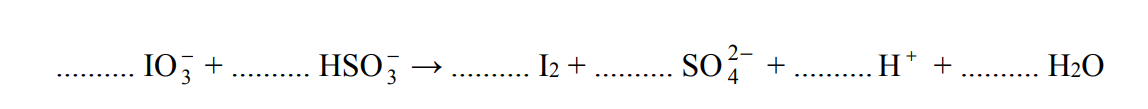
Reakcje związków aeromatycznych z kwasem azotowym(V)
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Związek aromatyczny o wzorze C8H10 reaguje ze stężonym kwasem azotowym(V) w obecności stężonego kwasu siarkowego(VI). Jeżeli molowy stosunek stechiometryczny substratów tej reakcji wynosi 1 : 1, to powstaje tylko jeden produkt organiczny.
Napisz wzór półstrukturalny (grupowy) organicznego produktu, który powstaje w reakcji związku aromatycznego o wzorze C8H10 z kwasem azotowym(V) w stosunku molowym 1 : 1.
Określ typ i mechanizm opisanej przemiany.
Typ reakcji:
Mechanizm:
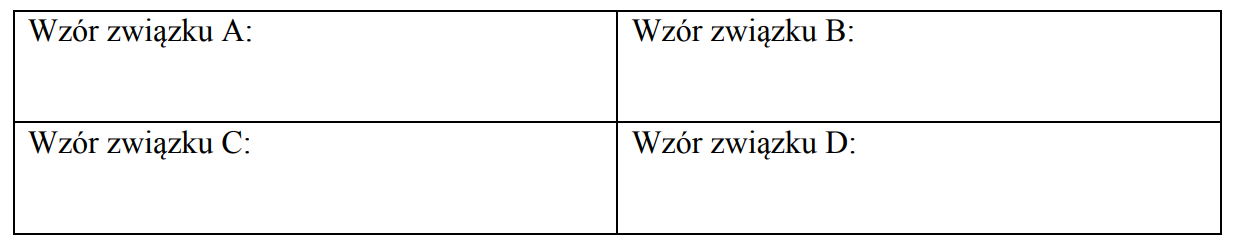
Addycja wodoru do aldehydów.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Pewien związek o wzorze ogólnym RCHO przekształcono w związek D w kilkuetapowym procesie przedstawionym na poniższym schemacie.

Literami A, B, C, D oznaczono pochodne węglowodorów.
Podaj wzory ogólne tych pochodnych.
Oblicz, ile centymetrów sześciennych wodnego roztworu kwasu etanowego o stężeniu równym 41,0%
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Oblicz, ile centymetrów sześciennych wodnego roztworu kwasu etanowego o stężeniu równym 41,0% masowych i gęstości 1,05 g·cm−3 należy rozcieńczyć wodą, aby otrzymać 200,00 cm3 roztworu kwasu etanowego o stężeniu 0,70 mol·dm−3.