ciąg przemian chemicznych
Arkusz z chemii rozszerzonej marzec 2021
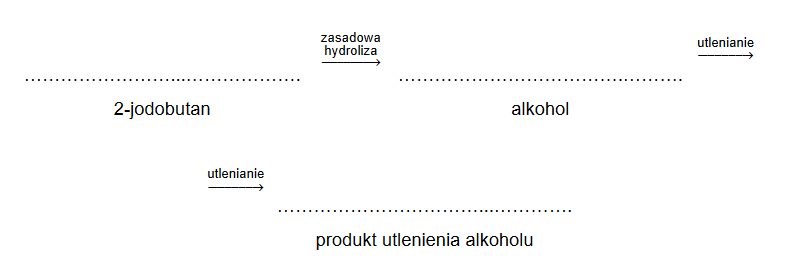
Poniżej przedstawiono ciąg przemian chemicznych, w których biorą udział związki organiczne, umownie oznaczone literami A, B, C i D, a produktem ostatecznym jest 2-bromopropan. Związek B jest izomerem, w którym atom chloru jest przyłączony do atomu węgla o niższej rzędowości.
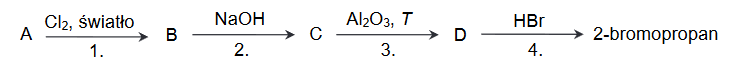
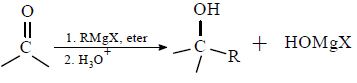
1. Napisz równania reakcji oznaczonych numerami 1 i 3. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Reakcja 1.:
Reakcja 3.:
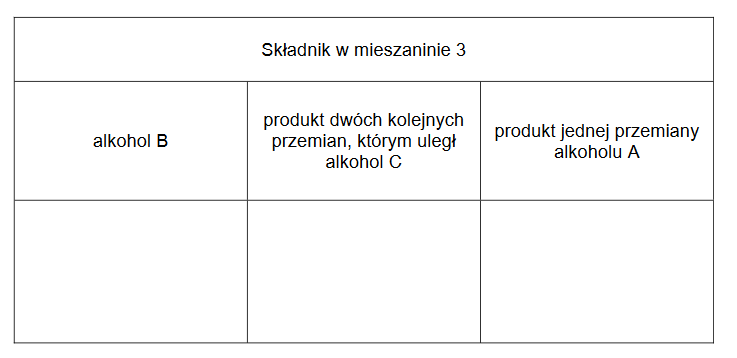
2. Uzupełnij poniższą tabelę. Określ typ reakcji 2. (addycja, eliminacja, substytucja) oraz jej mechanizm (rodnikowy, elektrofilowy, nukleofilowy).

porównania mocy substancji chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
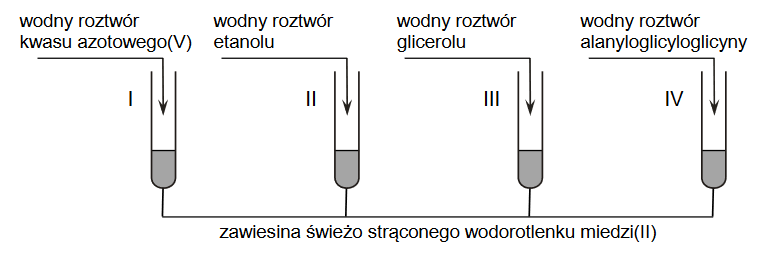
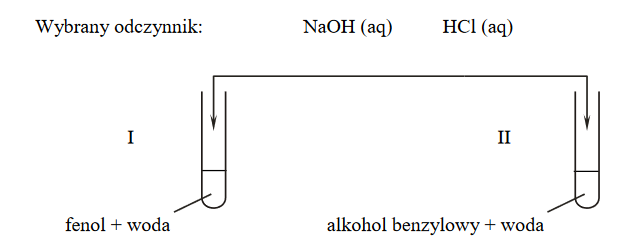
W celu porównania mocy kwasu siarkowego(VI), fenolu, kwasu etanowego i kwasu węglowego przeprowadzono doświadczenie zilustrowane poniższym schematem. Wszystkie użyte roztwory zostały świeżo przygotowane.
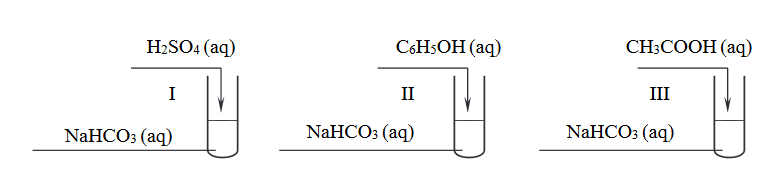
W probówkach I i III zaobserwowano wydzielanie się pęcherzyków gazu, a w probówce II – po zmieszaniu wodnych roztworów użytych do doświadczenia – nie przebiegła reakcja wodorowęglanu sodu z fenolem.
1. Sformułowane obserwacje i wnioski nie pozwalają na jednoznaczne określenie mocy badanych kwasów.
Jaką reakcję chemiczną należy dodatkowo przeprowadzić, aby możliwe było uszeregowanie wszystkich badanych kwasów od najsłabszego do najmocniejszego? Uzupełnij schemat – wybierz i podkreśl wzór jednego odczynnika z zestawu I oraz wzór jednego odczynnika z zestawu II.
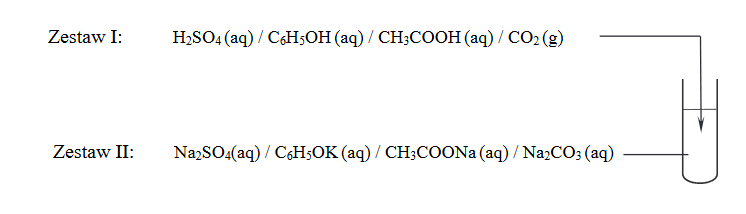
2. Napisz w formie cząsteczkowej równanie reakcji zachodzącej podczas dodatkowego doświadczenia.
porównanie temperatury wrzenia alkoholi i aldehydów
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W tabeli podano temperatury wrzenia (pod ciśnieniem 1013 hPa) wybranych alkoholi i aldehydów.
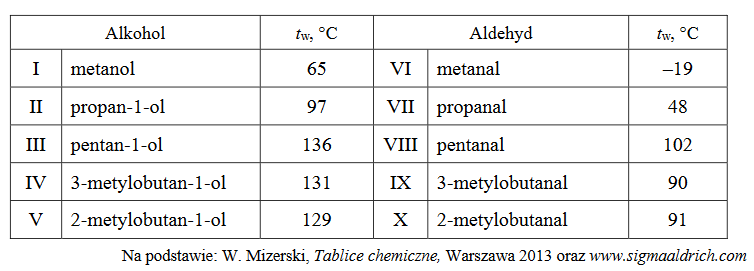
1. Wyjaśnij, dlaczego alkohole mają wyższe temperatury wrzenia niż aldehydy o takim samym szkielecie węglowym.
2. Spośród związków wymienionych w tabeli wybierz te, których cząsteczki są chiralne. Napisz numery, którymi je oznaczono.
założenia teorii strukturalnej budowy związków organicznych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
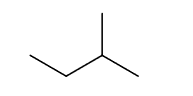
Wzory szkieletowe związków organicznych odzwierciedlają kształt łańcucha węglowego, dlatego lepiej oddają rzeczywistą strukturę cząsteczki. Są to wzory, w których nie zapisuje się symboli atomów węgla i połączonych z nimi atomów wodoru, ale rysuje się w postaci łamanej szkielet węglowy oraz zaznacza występujące w cząsteczce wiązania wielokrotne i zapisuje wzory grup funkcyjnych oraz symbole podstawników innych niż wodór, np. wzór szkieletowy
2-metylobutanu ma postać:
Poniżej przedstawiono wzory szkieletowe trzech związków organicznych.
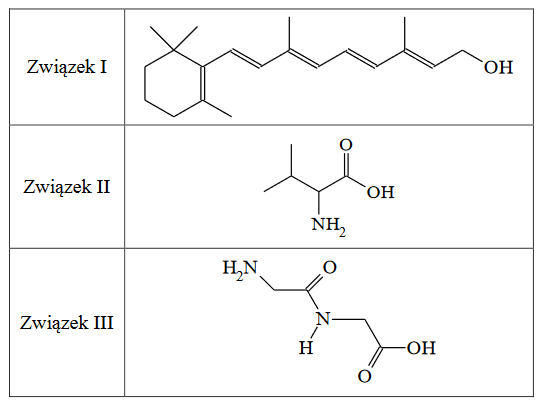
1. Napisz wzór sumaryczny związku II o wzorze szkieletowym podanym w tabeli.
2. Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

W probówce I umieszczono kilka kryształków fenolu C6H5OH i dolano wody destylowanej.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
W probówce I umieszczono kilka kryształków fenolu C6H5OH i dolano wody destylowanej. Następnie zawartość probówki ogrzano aż do powstania klarownego roztworu. Otrzymany roztwór ochłodzono do temperatury pokojowej i zaobserwowano, że zawartość probówki zmętniała. Do probówki II wprowadzono kilka kropli bezbarwnego alkoholu benzylowego C6H5CH2OH i dolano wody destylowanej. Zawartość probówki energicznie wymieszano i otrzymano mętną emulsję. Doświadczenie przeprowadzono pod wyciągiem.
Do przygotowanych w sposób opisany powyżej zawartości probówki I i zawartości probówkiII dodano pewien odczynnik. Zaobserwowano, że w probówce I powstał klarowny roztwór, a w probówce II nie stwierdzono zmiany wyglądu znajdującej się w niej emulsji.
Uzupełnij schemat doświadczenia – podkreśl wzór odczynnika, który dodano do mieszaniny fenolu z wodą i do mieszaniny alkoholu benzylowego z wodą.
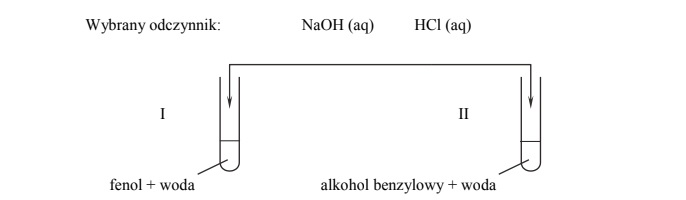
Napisz w formie jonowej skróconej równanie reakcji, której przebieg był przyczyną obserwowanych zmian po dodaniu wybranego odczynnika. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone reagentów organicznych.
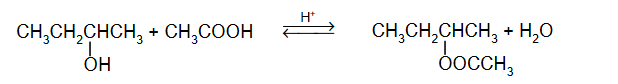
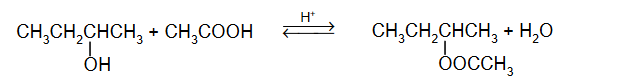
Otrzymywanie etanolu i aniliny.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Poniżej przedstawiono ciągi przemian, w wyniku których otrzymano anilinę oraz etanol.
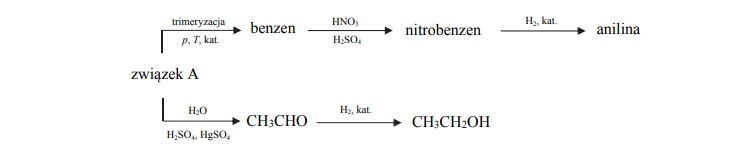
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest
prawdziwa, albo F – jeśli jest fałszywa.