Kwas pantotenowy – skład witaminy B5
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Kwas pantotenowy wchodzi w skład witaminy B5. Jego wzór chemiczny przedstawiono poniżej:
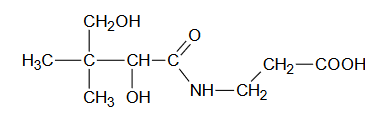
Kwas pantotenowy może ulegać hydrolizie zasadowej.
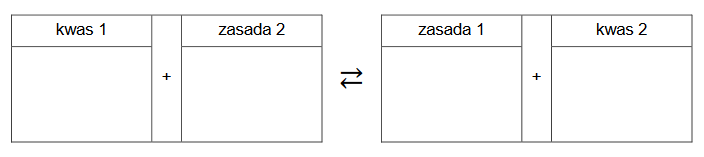
1. Uzupełnij poniższy schemat, tak aby przedstawiał w formie jonowej skróconej równanie hydrolizy zasadowej kwasu pantotenowego. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
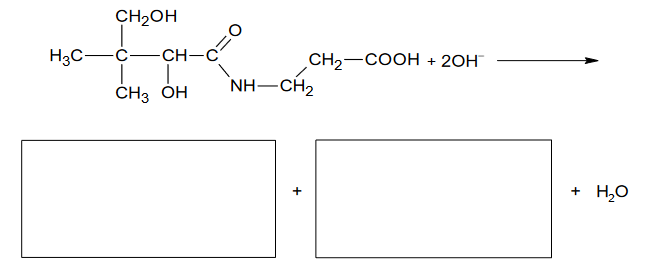
2. Rozstrzygnij, czy cząsteczka kwasu pantotenowego jest chiralna. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Nomex – polimer stosowany do produkcji materiałów
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
Nomex to polimer stosowany do produkcji materiałów o wysokiej odporności mechanicznej i termicznej. Fragment jego łańcucha przedstawiono poniżej:
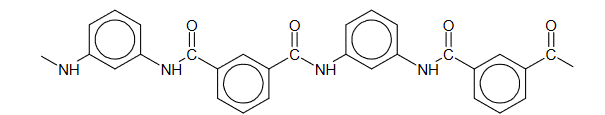
Monomery, z których można otrzymać nomex, różnią się charakterem kwasowo-zasadowym.
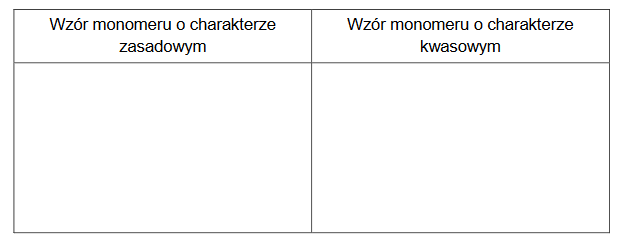
1. Uzupełnij tabelę. Narysuj wzory półstrukturalne (grupowe) lub uproszczone dwóch monomerów, z których można otrzymać ten polimer.
2. Uzupełnij zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie.
Nomex otrzymuje się w wyniku polimeryzacji (łańcuchowej / kondensacyjnej). W tej przemianie (wydziela się / nie wydziela się) produkt uboczny.
skrócony zapis reakcji jądrowych
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
Przebieg reakcji jądrowych można przedstawić w postaci zapisu skróconego. Na pierwszym miejscu podaje się symbol jądra bombardowanego, następnie w nawiasie – kolejno – symbole cząstki bombardującej i lekkiej cząstki emitowanej, a na końcu – symbol jądra produktu.
Pewien izotop kobaltu można otrzymać w przemianach jądrowych, których sumaryczny przebieg przedstawiono na poniższym schemacie. Symbol e oznacza elektron.
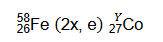
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz L. Jones, P. Atkins, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2016.
Napisz równanie przemiany jądrowej, która przebiega według powyższego schematu. Uzupełnij wszystkie pola odpowiednimi symbolami i wartościami liczbowymi.
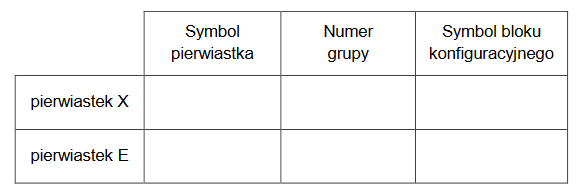
oddziaływania pomiędzy atomomami
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
Uzupełnij zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
1) Tlen i siarka tworzą wodorki typu H2E. Energia oddziaływań pomiędzy cząsteczkami wody jest (większa / mniejsza) niż energia oddziaływań pomiędzy cząsteczkami siarkowodoru.
2) Woda w postaci lodu tworzy kryształ (molekularny / kowalencyjny).
hydroliza wodnego roztworu tetraoksokrzemianu(IV) sodu
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
Stapianie tlenku krzemu(IV) z wodorotlenkiem sodu pozwala otrzymać różne krzemiany, w zależności od stosunku molowego substratów tej reakcji. Wskutek hydrolizy wodnego roztworu tetraoksokrzemianu(IV) sodu, czyli Na4SiO4, tworzy się roztwór silnie alkaliczny. Taki roztwór obok cząsteczek kwasu tetraoksokrzemowego(IV) zawiera wszystkie rodzaje wodoroanionów tego kwasu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010
1. Napisz w formie cząsteczkowej równanie reakcji otrzymywania tetraoksokrzemianu(IV) sodu opisaną metodą. Oblicz stosunek masowy substratów.
Równanie reakcji:
Stosunek masowy:
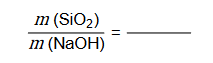
2. Napisz wzór sumaryczny tego wodoroanionu kwasu tetraoksokrzemowego(IV), który zbudowany jest z siedmiu atomów.
3. Narysuj elektronowy wzór kreskowy kwasu tetraoksokrzemowego(IV). Określ typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu krzemu w cząsteczce tego kwasu.
Elektronowy wzór kreskowy:
Typ hybrydyzacji:
proces prażenia mieszaniny
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
W celu określenia zawartości tlenku kobaltu(II) w mieszaninie zawierającej tylko CoO i Co3O4 próbkę tej mieszaniny o masie 100 g poddano prażeniu. Podczas tego procesu zaszły reakcje chemiczne:
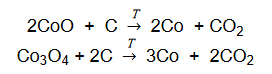
W wyniku zachodzących reakcji otrzymano 75,0 g metalicznego kobaltu.
Oblicz w procentach masowych zawartość tlenku kobaltu(II) w wyjściowej mieszaninie. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100 %.
Obliczenia:
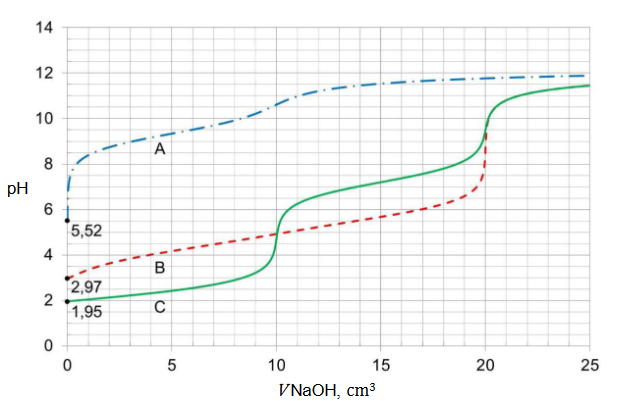
Obliczenia w roztworach wodnych
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
W 150 g wody o temperaturze 80 °C rozpuszczono 160 g bezwodnego tiosiarczanu sodu (Na2S2O3). Otrzymany roztwór ochłodzono do temperatury 20 °C.
Oblicz, ile gramów Na2S2O3 ∙ 5H2O wykrystalizuje po ochłodzeniu roztworu. W temperaturze 𝟐𝟎 °𝐂 rozpuszczalność hydratu wynosi 𝟏𝟕𝟔 𝐠 w 𝟏𝟎𝟎 𝐠 wody.
obliczanie stężenia roztworu wodnego
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
Zmieszano 500 cm3 wodnego roztworu wodorotlenku sodu o nieznanym stężeniu 𝑐 (roztwór A) i 250 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,10 mol‧dm-3 (roztwór B). W temperaturze 25°C pH otrzymanego roztworu C wynosiło 12,7.
Oblicz stężenie molowe 𝒄 roztworu A wodorotlenku sodu. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów. Wynik podaj z odpowiednią jednostką.
Obliczenia:
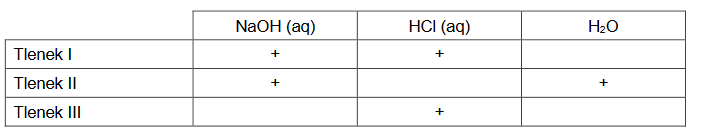
identyfikacja roztworów
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
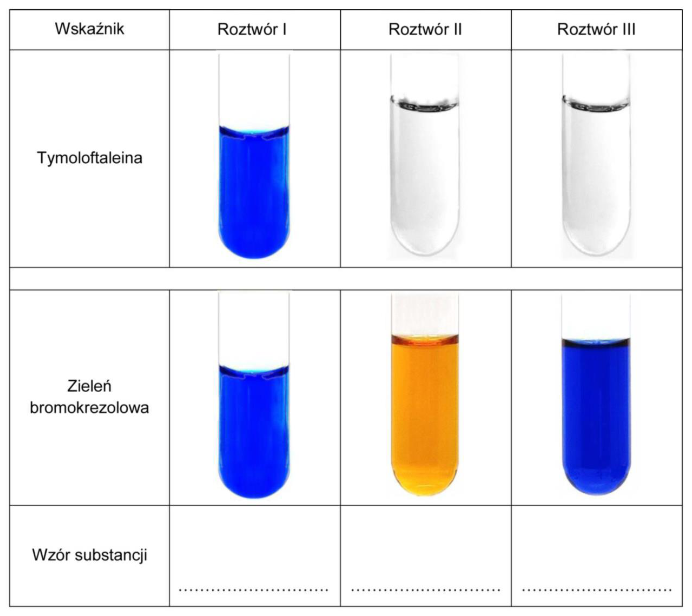
W temperaturze 𝑇 sporządzono trzy bezbarwne wodne roztwory:
• I – octanu sodu (CH3COONa)
• II – kwasu octowego (CH3COOH)
• III – wodorotlenku sodu (NaOH)
o jednakowych stężeniach molowych równych 0,01 mol‧dm-3.
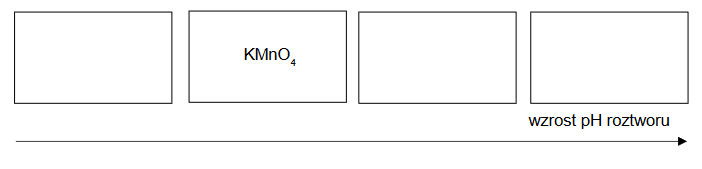
Do identyfikacji tych roztworów wybrano dwa wskaźniki kwasowo-zasadowe: tymoloftaleinę i zieleń bromokrezolową. Wyniki doświadczenia przedstawiono na zdjęciach.
Uzupełnij tabelę. Wpisz wzory substancji, których wodne roztwory identyfikowano.
otrzymywanie wodorotleneku glinu
Arkusz z chemii rozszerzonej czerwiec 2023 nowa formuła
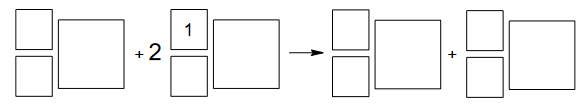
Uczniowie przeprowadzili dwuetapowe doświadczenie, w którym w temperaturze pokojowej otrzymali z metalicznego glinu wodorotlenek glinu.
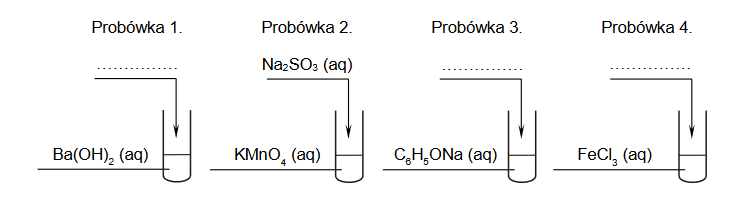
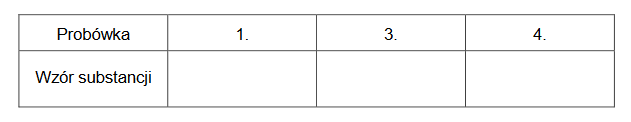
1. Wybierz i zaznacz na poniższym schemacie wzory odczynników, których użyto podczas doświadczenia przeprowadzonego przez uczniów.
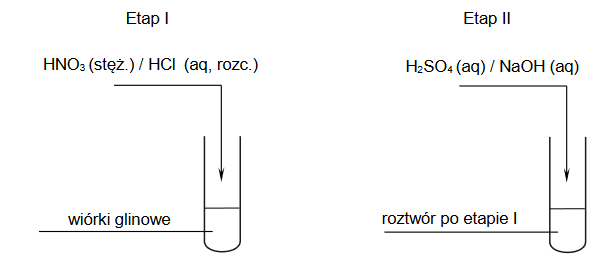
2. Zapisz w formie jonowej skróconej:
• równanie reakcji zachodzącej w etapie I
• równanie reakcji zachodzącej w etapie II
opisanego doświadczenia, a następnie napisz, jakie zmiany zaobserwowano po
dodaniu – w etapie II – nadmiaru wybranego odczynnika.
Równania reakcji:
Etap I:
Etap II:
Zaobserwowane zmiany: