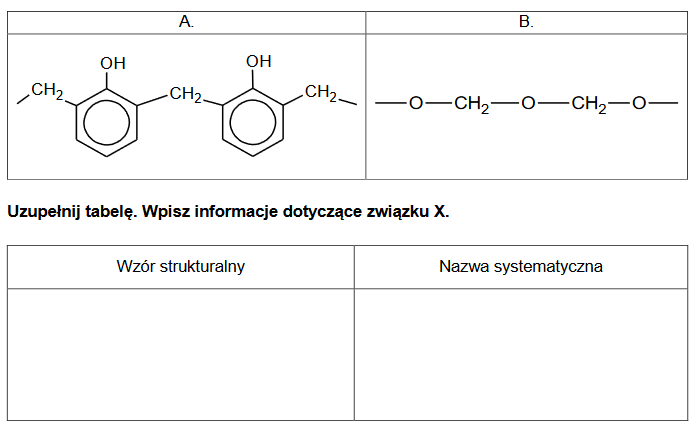
wzory półstrukturalne związków organicznych
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
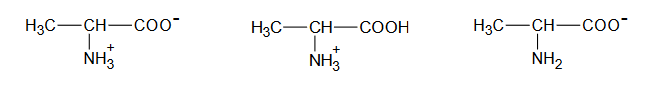
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.
1. Wybierz związek (A, B albo C), którego cząsteczki są chiralne, i napisz literę, którą oznaczono jego wzór. Uzasadnij swój wybór – odwołaj się do budowy cząsteczek tego związku.
Związek:
Uzasadnienie:
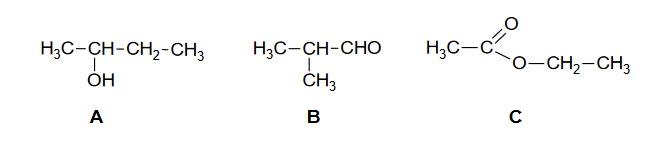
2. Każdy ze związków A, B, C ma izomery. Poniżej opisano trzy z nich – oznaczone odpowiednio jako związki A1, B1, C1.
• Związek A1 to izomer związku A, który można utlenić do związku B.
• Związek B1 to izomer związku B, który można zredukować do związku A.
• Związek C1 to izomer związku C, który można otrzymać przez utlenienie związku B.
Narysuj wzory półstrukturalne (grupowe) związków A1, B1 i C1.
geranial oraz geraniol – związki zapachowe
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch związków zapachowych: geranialu oraz geraniolu.
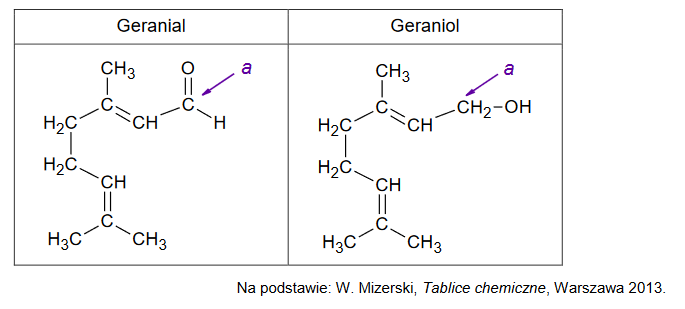
1. Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a w cząsteczkach geranialu i geraniolu.

2. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

zalkalizowana zawiesina wodorotlenku miedzi(II)
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Przygotowano zalkalizowaną zawiesinę wodorotlenku miedzi(II). Wygląd zawartości probówki przedstawiono na zdjęciu obok.
Wykonano doświadczenie: do probówki zawierającej otrzymany odczynnik wprowadzono wodny roztwór glukozy i wymieszano zawartość naczynia (I etap). Następnie probówkę ogrzano (II etap).

Na poniższych zdjęciach przedstawiono wygląd zawartości probówki po każdym z dwóch etapów doświadczenia.

Na podstawie wyniku I etapu doświadczenia sformułuj i napisz wniosek dotyczący budowy cząsteczki glukozy, a na podstawie wyniku II etapu doświadczenia – wniosek dotyczący właściwości tego monosacharydu.
Wniosek dotyczący budowy cząsteczki glukozy:
Wniosek dotyczący właściwości glukozy:
budowa monosacharydów
Arkusz z chemii rozszerzonej maj 2023 nowa formuła
Poniżej przedstawiono wzory ilustrujące budowę pary monosacharydów.
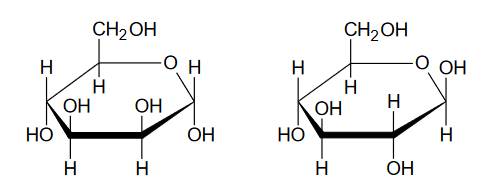
1. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

2. Dokończ zdanie. Wybierz i zaznacz odpowiedź A albo B oraz uzasadnienie 1., 2. albo 3.
Przedstawione monosacharydy są względem siebie

identyfikacja alkanu
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Pewien alkan, którego achiralne cząsteczki mają rozgałęziony łańcuch węglowy, w temperaturze 𝑇 i pod ciśnieniem 𝑝 jest gazem i ma gęstość 50 razy większą od gęstości wodoru wyznaczonej w tych samych warunkach. W reakcji chlorowania tego alkanu może powstać 6 różnych monochloropochodnych, będących izomerami konstytucyjnymi (bez uwzględniania stereoizomerów).
Oblicz liczbę atomów węgla w cząsteczce opisanego alkanu oraz napisz jego wzór półstrukturalny (grupowy).
ciąg przemian chemicznych
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Na poniższym schemacie zilustrowano ciąg przemian chemicznych. Literami X oraz Y oznaczono produkty organiczne kolejnych przemian.
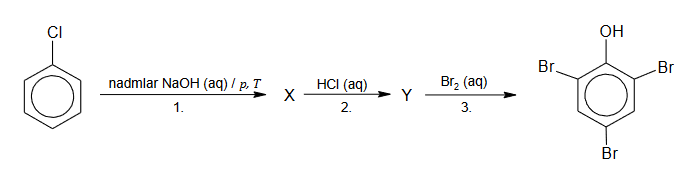
1. Napisz w formie jonowej skróconej równania reakcji 1. i 2. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Równanie reakcji 1.:
Równanie reakcji 2.
2. Uzupełnij poniższe zdanie. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Organiczny produkt reakcji 3. powstaje w procesie (substytucji / addycji / eliminacji) zachodzącym według mechanizmu (rodnikowego / elektrofilowego / nukleofilowego).
identyfikacja związków organicznych
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.
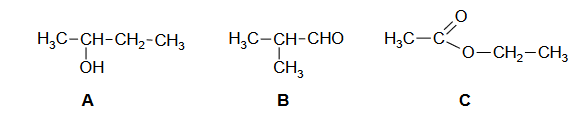
1. Wybierz związek (A, B albo C), którego cząsteczki są chiralne, i napisz literę, którą oznaczono jego wzór. Uzasadnij swój wybór. W uzasadnieniu odwołaj się do budowy cząsteczek tego związku.
Związek:
Uzasadnienie:
2. Każdy ze związków A, B, C ma izomery. Poniżej opisano trzy z nich – oznaczone odpowiednio jako związki A1, B1, C1.
• Związek A1 to izomer związku A, który można utlenić do związku B.
• Związek B1 to izomer związku B, który można zredukować do związku A.
• Związek C1 to izomer związku C, który można otrzymać przez utlenienie związku B.
Narysuj wzory półstrukturalne (grupowe) związków A1, B1 i C1.
związki zapachowe- geranial oraz geraniol
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch związków zapachowych: geranialu oraz geraniolu.
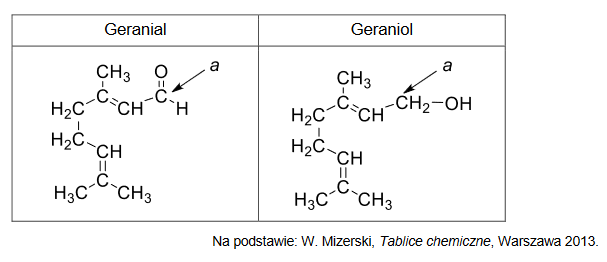
1. Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a w cząsteczkach geranialu i geraniolu.

2. Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

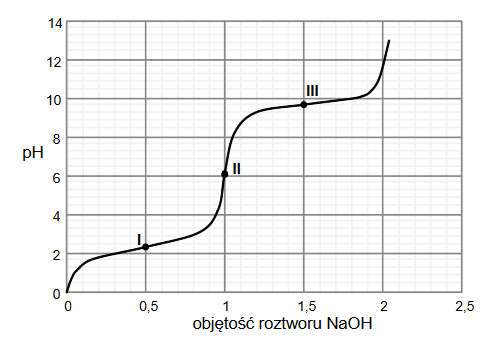
badanie mocy kwasów
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Badano właściwości czterech kwasów. Podczas doświadczenia stwierdzono, że zachodzą następujące reakcje:
CHCl2–COOH + CH2Cl–COONa → CHCl2–COONa + CH2Cl–COOH
CH2Cl–COOH + CH3–COONa → CH2Cl–COONa + CH3–COOH
CH2Cl–COOH + C6H5–COONa → CH2Cl–COONa + C6H5–COOH
a reakcja:
C6H5–COONa + CH3–COOH → nie zachodzi
Na podstawie wyników przeprowadzonego doświadczenia uporządkuj badane kwasy od najsłabszego do najmocniejszego.
PABA – Kwas 4-aminobenzoesowy
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Kwas 4–aminobenzoesowy (PABA) jest substratem do produkcji niektórych leków oraz jednym z substratów enzymatycznej syntezy kwasu foliowego. Poniżej przedstawiono schemat syntezy kwasu 4–aminobenzoesowego z toluenu.
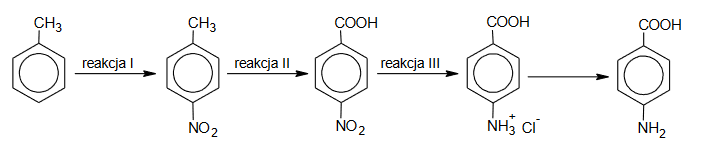
Poniżej wymieniono sześć odczynników:
1. KMnO4 (aq) / H2SO4 (aq)
2. HCl (aq) / Zn (s)
3. NH4Cl (aq)
4. HNO3 (stężony) / H2SO4 (stężony)
5. odczynnik Tollensa
6. NaOH (aq)
Spośród wymienionych odczynników wybierz wszystkie te, które należy zastosować w kolejnych etapach syntezy PABA (reakcje I–III). Napisz numery, którymi oznaczono wzory tych odczynników.
Reakcja I: ….
Reakcja II: ….
Reakcja III: ….
identyfikacja pewnego alkoholu
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Ester o wzorze sumarycznym C5H10O2 poddano hydrolizie w środowisku kwasowym i otrzymano kwas A oraz alkohol X. W wyniku przeprowadzonych badań kwasu i alkoholu ustalono, że:
• po tym, jak do roztworu manganianu(VII) potasu zakwaszonego kwasem siarkowym(VI) dodano wodny roztwór kwasu A, nastąpiło odbarwienie zawartości probówki, a także zaobserwowano wydzielenie bezbarwnego i bezwonnego gazu
• w wyniku przepuszczenia oparów alkoholu X nad rozżarzonym tlenkiem miedzi(II) powstaje związek, który nie wykazuje właściwości redukujących w próbie Tollensa.
Uzupełnij poniższą tabelę. Narysuj wzory półstrukturalne (grupowe) kwasu A i alkoholu X oraz napisz nazwę systematyczną alkoholu X.

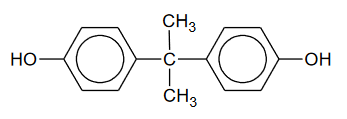
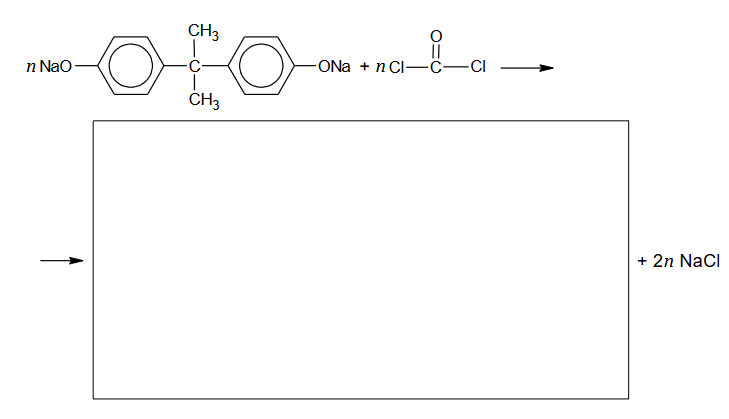
procesy polimeryzacji i kondensacji
Arkusz diagnostyczny z chemii 2022 grudzień
Związek organiczny X jest substratem w procesach produkcji niektórych tworzyw sztucznych. Ten związek ulega reakcji polimeryzacji i jest stosowany jako jeden z reagentów w procesach polikondensacji. Niżej przedstawione są wzory fragmentów łańcucha dwóch polimerów (oznaczonych literami A i B), w których syntezie bierze udział związek X.