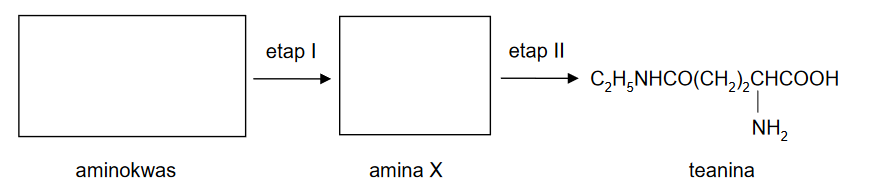
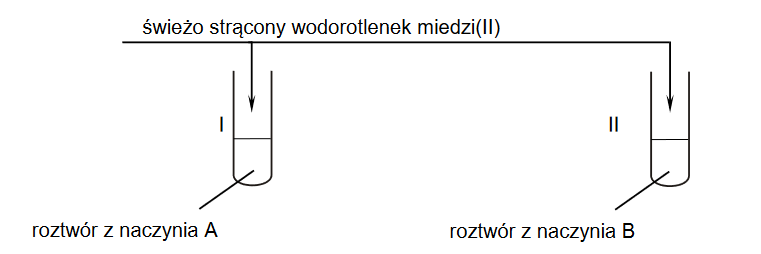
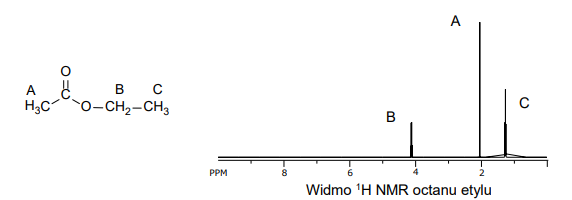
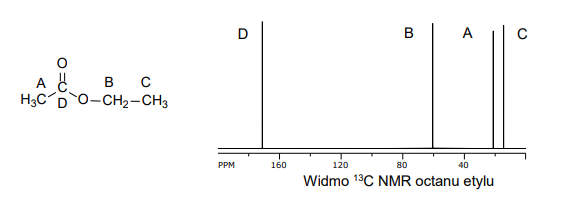
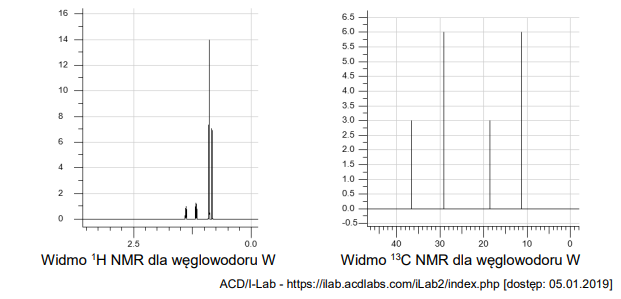
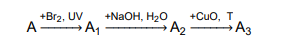reakcje substytucji, addycji i eliminacji
Arkusz diagnostyczny z chemii 2022 grudzień
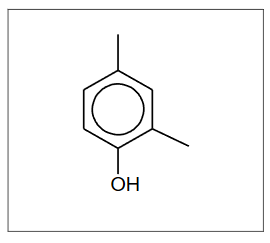
Jedną z monobromopochodnych butanu (związek A) poddano reakcji z KOH w bezwodnym etanolu (reakcja 1.), a na otrzymany związek B podziałano bromowodorem (reakcja 2.). Główny produkt C był izomerem związku A.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Następnie uzupełnij tabelę. Napisz wzory półstrukturalne (grupowe) związków A i C.
Związek B powstał w reakcji (substytucji / addycji / eliminacji), a jego przemiana w związek C jest przykładem reakcji (substytucji / addycji / eliminacji).
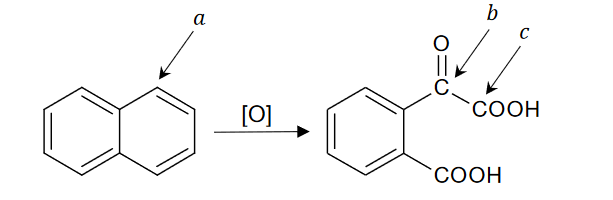
właściwości chemiczne węglowodorów aromatycznych
Arkusz diagnostyczny z chemii 2022 grudzień
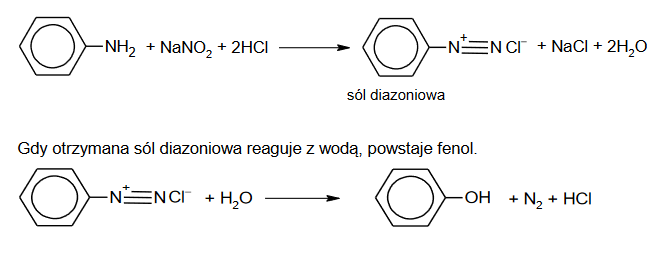
W wyniku działania kwasem azotowym(III) na pierwszorzędowe aminy aromatyczne powstają tzw. sole diazoniowe, które znajdują zastosowanie w syntezie organicznej.
W praktyce, zamiast nietrwałego kwasu azotowego(III) stosuje się jego sól w obecności mocnego kwasu. Przykład takiej reakcji z udziałem aniliny zilustrowano równaniem:
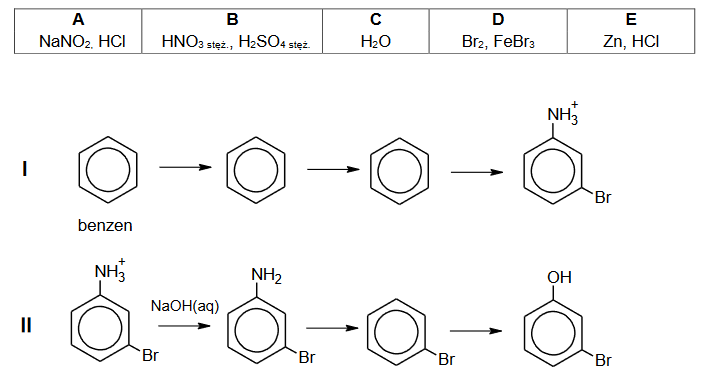
Opisane przemiany mogą być stosowane w celu otrzymania pochodnych benzenu, w których podstawniki kierujące w pozycje orto– i para– znajdują się względem siebie w pozycji meta–.
Zaprojektuj ciąg przemian, w wyniku których z benzenu powstanie 3–bromofenol – uzupełnij w poniższym, dwuczęściowym schemacie wzory produktów pośrednich, a nad każdą strzałką wpisz literę oznaczającą zestaw użytych reagentów. Zestawy odczynników wybierz spośród wymienionych poniżej.
skracanie łańcucha węglowego
Arkusz diagnostyczny z chemii 2022 grudzień
Jednym z procesów, którym mogą ulegać cukry, jest skracanie łańcucha węglowego. Jeżeli aldoheksozę podda się utlenieniu za pomocą wody bromowej, otrzymany kwas będzie można przekształcić w aldopentozę. Przykład takiego ciągu przemian przedstawiono na poniższym schemacie.
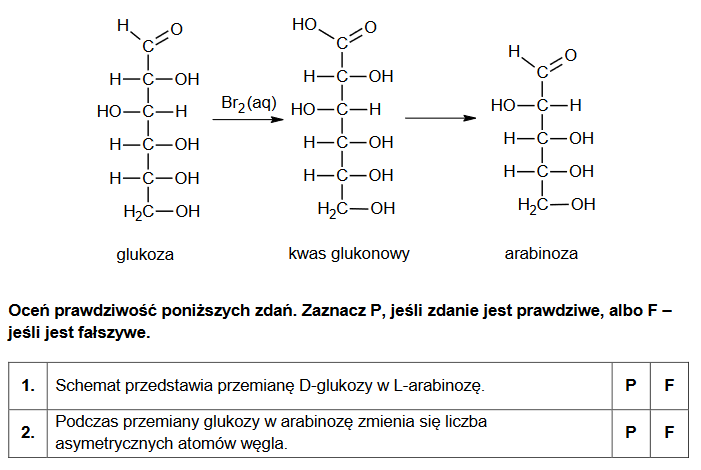
mechanizmy reakcji substytucji
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Mieszanina nitrująca to mieszanina dwóch stężonych kwasów: azotowego(V) i siarkowego(VI). Między jej składnikami zachodzi reakcja, w której powstaje produkt bezpośrednio reagujący z węglowodorem aromatycznym, np. z benzenem.
Uzupełnij poniższe zdania – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Benzen ulega reakcji substytucji (elektrofilowej / nukleofilowej / rodnikowej). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu podczas nitrowania, to (rodniki •NO2 / aniony NO2- / kationy NO2+ ).
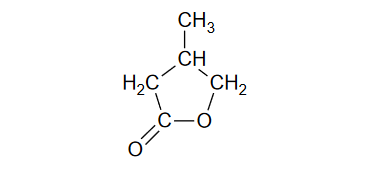
Maltol – produkt powstających w procesie karmelizacji cukrów
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Jednym z produktów powstających w procesie karmelizacji cukrów jest maltol – pierścieniowy związek o poniższym wzorze.
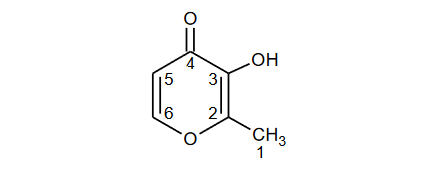
Wpisz do tabeli brakujące wartości formalnych stopni utlenienia atomów węgla w cząsteczce maltolu.

wzór półstrukturalny węglowodoru
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
O dwóch węglowodorach A i B, z których każdy ma wzór sumaryczny C6H12, wiadomo, że:
• węglowodór A powstaje w wyniku reakcji między 3–bromo–2,2–dimetylobutanem
a alkoholowym roztworem wodorotlenku sodu przebiegającej w podwyższonej
temperaturze;
• węglowodór B, będący alkanem cyklicznym, powstaje w reakcji zachodzącej pomiędzy
dibromopochodną heksanu a cynkiem, a w jego cząsteczce obecny jest jeden
trzeciorzędowy atom węgla połączony m.in. z grupą metylową.
1. Napisz w formie jonowej skróconej równanie reakcji otrzymywania węglowodoru A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
2. Narysuj wzór półstrukturalny (grupowy) lub uproszczony węglowodoru B oraz napisz jego nazwę systematyczną.

Nazwa systematyczna:
Kauczuk naturalny
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Poniżej przedstawiono wzór kauczuku naturalnego.
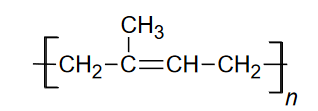
Dokończ zdanie. Zaznacz właściwą odpowiedź spośród podanych.
W laboratorium ten związek można otrzymać w reakcji polimeryzacji
A. 2–metylobut–1–enu.
B. 2–metylobuta–1,3–dienu.
C. 2–metylobut–2–enu.
D. 2–metylobuta–1,2–dienu.
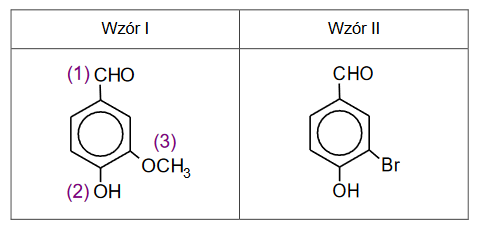
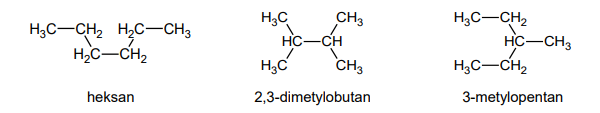
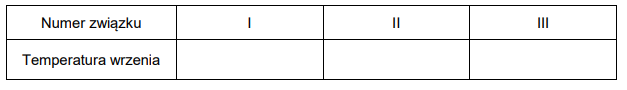
Temperatury wrzenia węglowodorów
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wzory trzech związków organicznych oznaczono numerami I–III i zestawiono w poniższej tabeli. Te związki różnią się wartościami temperatury wrzenia.
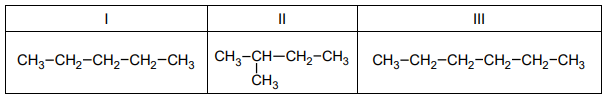
Poniżej przedstawiono – w przypadkowej kolejności – wartości temperatury wrzenia wymienionych związków (pod ciśnieniem 1013 hPa):
27,8 °C
36,1 °C
68,7 °C
Przyporządkuj każdemu związkowi charakteryzującą go temperaturę wrzenia. Uzupełnij tabelę. Podaj nazwę systematyczną związku o najwyższej temperaturze wrzenia i nazwę systematyczną związku o najniższej temperaturze wrzenia. W obu przypadkach uzasadnij swoje przyporządkowanie.
Nazwa systematyczna związku o najwyższej temperaturze wrzenia:
Uzasadnienie:
Nazwa systematyczna związku o najniższej temperaturze wrzenia:
Uzasadnienie: